题目内容
8.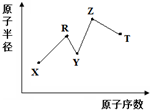 现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( )| A. | 离子半径:Y<Z | |
| B. | 氢化物的沸点:Y<T | |
| C. | 最高价氧化物对应水化物的酸性:T<R | |
| D. | 由X、Y、Z、R四种元素组成的常见化合物中含有离子键 |
分析 短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C或S,由图中原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Y与T同主族,则T应为S,X的原子半径最小,原子序数最小,则X为H元素,据此解答.
解答 解:短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C或S,由图中原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Y与T同主族,则T应为S,X的原子半径最小,原子序数最小,则X为H元素.
A.离子电子层结构相同,核电荷数越大离子半径越小,则离子半径O2->Na+,故A错误;
B.非金属性O>S,故氢化物稳定性:H2O>H2S,故B错误;
C.非金属性S>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C错误;
D.由H、O、Na、C四种元素组成的化合物为NaHCO3等,含有离子键,故D正确.
故选D.
点评 本题考查结构性质位置关系应用,侧重于学生的分析能力的考查,推断元素是解题的关键,D中注意还可以形成有机钠盐.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
18.常温下,1mol某烷烃在光照条件下与氯气发生取代反应,若在适当的条件下,完全取代需要消耗6mol Cl2,则下列判断正确的是( )
| A. | 该烷烃的分子式为C5H12 | |
| B. | 反应所生成的有机产物能直接使AgNO3溶液褪色 | |
| C. | 该烷烃的四氯代物有2种 | |
| D. | 反应容器中,一氯代物所占的物质的量分数最大 |
19.对于反应A(g)+3B(g)??2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
( )
( )
| A. | v(A)=0.5mol•(L•min)-1 | B. | v(B)=0.4mol•(L•s)-1 | ||
| C. | v(B)=0.3mol•(L•s)-1 | D. | v(C)=0.2mol•(L•s)-1 |
16.化合物M叫假蜜环菌甲素,它是香豆素类天然化合物.对M的性质叙述错误的是( )

| A. | 在镍作催化剂并加热的条件下,1molM最多可与6molH2发生加成反应 | |
| B. | M不可能使酸性KMnO4溶液褪色 | |
| C. | M可在热的NaOH溶液中发生反应,最多可消耗3molNaOH | |
| D. | 1molM最多可与2molBr2发生反应 |
3.下列有关实验原理或实验操作正确的是( )
| A. | 用NaOH溶液滴定CH3COOH溶液,可选用甲基橙作指示剂 | |
| B. | 用量筒量20mL0.5000mol•L-1H2SO4溶液于烧杯中,加水80mL,配制成0.1000mol•L-1H2SO4溶液 | |
| C. | 常温下,物质的量浓度均为0.1mol•L-1的盐酸、醋酸溶液,分别用水稀释100倍后pH的关系为:盐酸>醋酸 | |
| D. | 实验室常将氯化铁先溶于盐酸,再加水稀释来配制其溶液 |
13.下列化学用语表述正确的是( )
| A. | 二氧化硅的分子式:SiO2 | B. | 次氯酸的电子式: | ||
| C. | Cl─的结构示意图: | D. | 四氯化碳的比例模型: |
20.下列化学用语正确的是( )
| A. | 苯的结构式: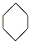 | |
| B. | 乙烯的结构简式C2H4 | |
| C. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| D. | 羟基(-OH)的电子式: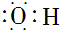 |
18.下列有关电解质溶液中的粒子浓度关系正确的是( )
| A. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| B. | 0.1mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1pH=4的NaHC2O4溶液:c(H2C2O4)>c(C2O42-) | |
| D. | 向1.0L0.1mol•L-1的醋酸钠溶液中加入1.0L0.1mol•L-1盐酸:c(Na+)>c(CH3COO-)>c(H+) |