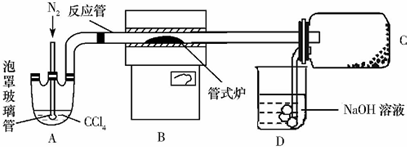
题目内容
1.从2L、1L/mol的NaOH溶液中取出100mL溶液,下面关于这100mL溶液的叙述错误的为( )①物质的量浓度为0.1mol/L
②物质的量浓度为1mol/L
③含有100mL水
④含有0.1molNaOH.
| A. | ①② | B. | ①③ | C. | ③② | D. | ②④ |
分析 溶液是均匀的,取出的氢氧化钠溶液浓度等于原溶液的浓度,根据n=cV计算取出溶液中氢氧化钠的物质的量,据此解答.
解答 解:溶液具有均一性,所以从2L、1mol/L的NaOH溶液中取出100mL溶液,溶液的物质的量浓度为1mol/L,溶液体积为100mL,则水的体积小于100mL,含有溶质的物质的量为:0.1L×1mol/L=0.1mol,所以正确的选项为:①③;
故选:B.
点评 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,注意溶液的均一性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.已知:a、b、c三物质间有转化关系a→b→c→a,物质间转化均只需要一步反应便能完成,则a、b、c不可能是( )
| A. | a:Fe b:FeCl3 c:FeCl2 | B. | a:AlCl3 b:Al(OH)3 c:Al2O3 | ||
| C. | a:N2 b:NH3 c:NO2 | D. | a:SO2 b:SO3 c:H2SO4 |
2.用下列实验装置进行相应实验,能达到实验目的是( )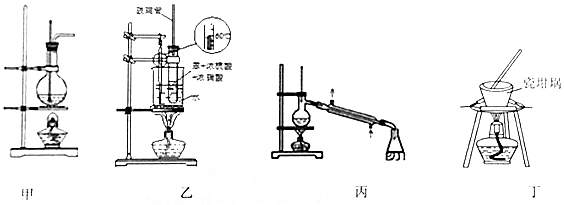

| A. | 装置甲:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物 | |
| B. | 装置乙:实验室中可用此装置来制备硝基苯 | |
| C. | 装置丙:实验室中可用此装置来分离含碘的四氯化碳溶液,最终在锥形瓶中收集到碘 | |
| D. | 用装置丁加热熔融NaOH固体 |
16.下列反应离子方程式正确的是( )
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- |
13.在指定条件下,下列各组离子一定能大量共存的是( )
| A. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| B. | 滴入KSCN显血红色的溶液中:NH4+、Mg2+、SO42-、Cl- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| D. | 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、K+、CO32-、NO3- |
10.下列实验操作中正确的是( )
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布盖灭 | |
| B. | 在取用NaOH固体时,发现取量过多,为了不浪费,又把多余的药品放回试剂瓶 | |
| C. | 用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜 | |
| D. | 制取并收集氧气结束后,应立即停止加热 |