题目内容
8.由于水电离吸热(填“吸热”或“放热”),因此升温水的电离平衡向正向移动,c(H+)增大、c(OH-)增大,pH=7,但由于c(H+)等于(大于、小于或等于)c(OH-),故溶液显中性.如100℃纯水中,c(H+)=c(OH-)=1×10-6mol/L,KW=10-12.分析 常温下水存在电离平衡,H2O?H++OH?,水的电离是吸热过程,若升高温度,促进电离,氢离子浓度与氢氧根离子浓度相等,以此解答该题.
解答 解:水的电离是吸热过程,升高温度,平衡正向移动,c(H+)、c(OH-) 增大,但由于c(H+)=c(OH-),则溶液呈中性,pH=7.
故答案为:吸热;正向;增大;增大;=7;等于;中.
点评 本题考查水的电离,为高频考点,侧重考查学生的分析能力,注意把握水的电离为吸热过程的特点,把握外界条件下对平衡移动的影响,难度不大.

练习册系列答案
相关题目
11. 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=+41.19 kJ•mol-1,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=$\frac{{K}_{1}}{{K}_{3}}$(用K1、K3表示).
(2)反应Ⅲ自发进行条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)在一定条件下2L恒容密闭容器中充入3mol H2和1.5mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示.
①T高于500℃(填“高于”或“低于”).
②温度为500℃时,该反应10min时达到平衡:
a.用H2表示该反应的速率为0.135mol•L-1•min-1;
b.该温度下,反应I的平衡常数K=200L2/mol2.
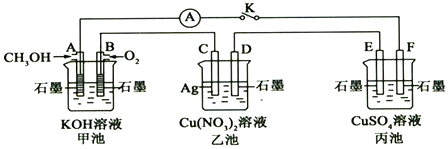
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示.
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是BD(选填编号).
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而增大(填“增大”、“减小”、“不变”或“无法判断”).
 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=+41.19 kJ•mol-1,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=$\frac{{K}_{1}}{{K}_{3}}$(用K1、K3表示).
(2)反应Ⅲ自发进行条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)在一定条件下2L恒容密闭容器中充入3mol H2和1.5mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示.
| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60% | 40% |
②温度为500℃时,该反应10min时达到平衡:
a.用H2表示该反应的速率为0.135mol•L-1•min-1;
b.该温度下,反应I的平衡常数K=200L2/mol2.
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示.
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是BD(选填编号).
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而增大(填“增大”、“减小”、“不变”或“无法判断”).
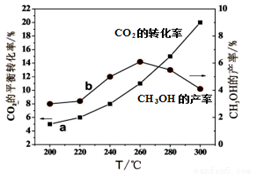
12. 己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
 己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )| A. | a代表20℃下A的Y-t曲线 | |
| B. | 反应到66min时,0℃和20℃下反应放出的热量相等 | |
| C. | 0℃和20℃下达到平衡时,反应都放出QkJ热量 | |
| D. | 反应都达到平衡后,正反应速率a>b |
13.可逆反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图.下列叙述正确的是( )
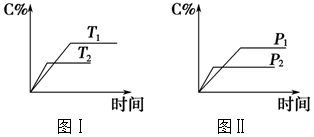

| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
20.研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域.已知CO2溶于海水主要以4种无机碳形式存在,其中HCO3-占95%,请按要求回答:
(1)CO2溶于水转化为HCO3-的方程式为:CO2+H2O?H2CO3,H2CO3?HCO3-+H+,对于此过程能说明已经达到平衡状态的是BD
A.混合体系中的碳总量保持不变 B.混合液的pH保持不变
C.HCO3-与H2CO3的浓度相等 D.HCO3-的百分含量保持不变
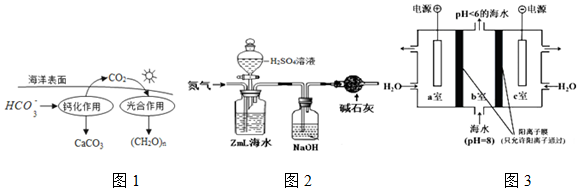
(2)在海洋循环中,通过如图1所示的途径固碳.写出钙化作用的离子方程式:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2.用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图2),该装置中干燥管的作用是防止空气中的二氧化碳进入被氢氧化钠溶液吸收.
②滴定.若Z mL海水中的无机碳恰好使NaOH吸收液完全转化为200mL的NaHCO3溶液,再用ymol/L的标准盐酸溶液滴定,有关数据记录如表:
根据相关数据,计算海水中溶解的无机碳的浓度$\frac{200y}{Z}$mol/L
(4)利用如图3所示装置从海水中提取CO2,有利于减少环境温室气体含量,结合方程式简述提取CO2的原理a室:2H2O-4e=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O.
(1)CO2溶于水转化为HCO3-的方程式为:CO2+H2O?H2CO3,H2CO3?HCO3-+H+,对于此过程能说明已经达到平衡状态的是BD

A.混合体系中的碳总量保持不变 B.混合液的pH保持不变
C.HCO3-与H2CO3的浓度相等 D.HCO3-的百分含量保持不变
(2)在海洋循环中,通过如图1所示的途径固碳.写出钙化作用的离子方程式:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2.用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图2),该装置中干燥管的作用是防止空气中的二氧化碳进入被氢氧化钠溶液吸收.
②滴定.若Z mL海水中的无机碳恰好使NaOH吸收液完全转化为200mL的NaHCO3溶液,再用ymol/L的标准盐酸溶液滴定,有关数据记录如表:
| 测定序号 | NaHCO3溶液的体积/mL | 盐酸标准液滴定管中的读数/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 1.50 | 21.52 |
| 2 | 20.00 | 1.80 | 25.62 |
| 3 | 20.00 | 0.20 | 20.18 |
(4)利用如图3所示装置从海水中提取CO2,有利于减少环境温室气体含量,结合方程式简述提取CO2的原理a室:2H2O-4e=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O.
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L0.5mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| B. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| C. | 室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | ag某气体含分子数为b,c g该气体在标况下的体积为$\frac{22.4ab}{c{N}_{A}}$L |
 实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题:
实验室某浓硫酸的试剂瓶上的标签如右图所示,根据标签上的有关数据回答下列问题: