题目内容
8.下列说法中正确的是( )| A. | 因为p轨道是“8”字形的,所以p电子走“8”字形 | |
| B. | 第三电子层,有3s、3p、3d三个轨道 | |
| C. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| D. | 一般情况下,σ键比π键重叠程度大,形成的共价键强 |
分析 A.电子在原子轨道中作无规则运动;
B.在第三能层中只有3个亚层共8个原子轨道;
C.每个轨道中最多可以填充两个电子,自旋相反,这两个电子的能量完全相同,另外在等价轨道上填充的电子能量也相同;
D.σ键是头碰头的重叠,π键是肩并肩的重叠,σ键比π键重叠程度大.
解答 解:A.电子在原子轨道中作无规则运动,所以电子不是按照某种形状运动的,故A错误;
B.在第三能层中有3s,3p,3d,只有3个亚层共8个原子轨道,故B错误;
C.每个轨道中最多可以填充两个电子,自旋相反,两个电子的能量完全相同,另外在等价轨道上填充的电子能量也相同,可能存在能量相同的电子,故C错误;
D.σ键是头碰头的重叠,π键是肩并肩的重叠,σ键比π键重叠程度大,σ键比π键稳定,故D正确.
故选D.
点评 本题考查了电子层和原子轨道及化学键的有关知识,每个轨道最多排两个电子,能量相等,自旋方向相反,σ键是头碰头的重叠,π键是肩并肩的重叠,σ键比π键重叠程度大,σ键比π键稳定,要求学生掌握基础知识,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
19.下列有机物的名称错误的是( )
| A. | 1,1,2,2-四溴乙烷 | B. | 2-甲基-3-丁烯 | ||
| C. | 3-乙基戊烷 | D. | 2,4,6-三硝基甲苯 |
16.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂.下列说法正确的是( )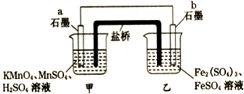

| A. | b电极上发生的反应:Fe2+-e-═Fe3+ | |
| B. | a电极上发生氧化反应:MnO4-+8H++5e-═Mn2++4H2O | |
| C. | 外电路电子的流向是从a到b | |
| D. | 电池工作时,盐桥中的SO42-移向甲烧杯 |
20.化学中将具有的原子数相同、最外层电子数之和相同的粒子称为等电子体.下列各组中的物质属于等电子体的是( )
| A. | CN-和N2 | B. | NO和O2 | C. | NO2和CO2 | D. | SO2和ClO2 |
17.甲醛的分子式为CH2O,常温下是气体,有毒.下列分析正确的是( )
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |

 .
.