题目内容
9.依据元素周期表及元素周期律,下列推断正确的是( )| A. | H3BO3的酸性比H2CO3的强 | |
| B. | Mg(OH)2的碱性比Be(OH)2的强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
分析 A.同周期从左向右非金属性增强,非金属性强的对应最高价含氧酸的酸性强;
B.同主族从上到下金属性增强,金属性越强对应最高价氧化物的水化物碱性越强;
C.同周期从左向右原子半径减小;
D.具有相同电子排布的离子,阴离子在上一周期后方,阳离子在下一周期前方.
解答 解:A.同周期从左向右非金属性增强,非金属性强的对应最高价含氧酸的酸性强,则H3BO3的酸性比H2CO3的弱,故A错误;
B.同主族从上到下金属性增强,金属性越强对应最高价氧化物的水化物碱性越强,则Mg(OH)2的碱性比Be(OH)2的强,故B正确;
C.同周期从左向右原子半径减小,则C、N、O原子半径依次减小,故C错误;
D.具有相同电子排布的离子,阴离子在上一周期后方,阳离子在下一周期前方,则M+和R2-的核外电子层结构相同,则原子序数:M>R,故D错误;
故选B.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质为解答本题的关键,注意元素周期律的应用,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
19.下列有机物的名称错误的是( )
| A. | 1,1,2,2-四溴乙烷 | B. | 2-甲基-3-丁烯 | ||
| C. | 3-乙基戊烷 | D. | 2,4,6-三硝基甲苯 |
20.化学中将具有的原子数相同、最外层电子数之和相同的粒子称为等电子体.下列各组中的物质属于等电子体的是( )
| A. | CN-和N2 | B. | NO和O2 | C. | NO2和CO2 | D. | SO2和ClO2 |
17.甲醛的分子式为CH2O,常温下是气体,有毒.下列分析正确的是( )
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |
1.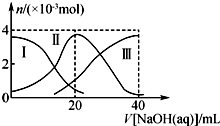 常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
 常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )| A. | H2A在水中的电离方程式为H2A═H++HA-,HA-?H++A2- | |
| B. | 向NaHA溶液中加水,HA-的电离度增大、溶液的pH减小 | |
| C. | V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)-2c(OH-)=c(A2-)-3c(H2A)-c(HA-) |
 X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.
X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.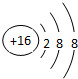 ;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.
;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.