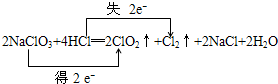
题目内容
10.常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )| A. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa混合液,溶液显酸性,则溶液中粒子浓度:c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-) | |
| B. | 浓度均为0.1 mol•L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)═2c(H+)+c(HA) | |
| D. | 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)═c(OH-)+c(HA-)+c(A2-) |
分析 A.浓度均为0.1 mol•L-1的CH3COOH和CH3COONa混合液,溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,结合物料守恒判断;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液中溶质为等物质的量浓度的HA、NaA,溶液的pH大于7,说明HA的电离程度小于NaA水解程度,根据溶液中电荷守恒和物料守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.浓度均为0.1 mol•L-1的CH3COOH和CH3COONa混合液,溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COOH)<c(CH3COO-),弱电解质的电离较微弱,结合物料守恒得c(CH3COO-)>c (Na+)>c(CH3COOH)>c(H+)>c(OH-),故A错误;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故B错误;
C.将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液中溶质为等物质的量浓度的HA、NaA,溶液的pH大于7,说明HA的电离程度小于NaA水解程度,电荷守恒:c(OH-)+c(A-)=c(H+)+c(Na+),存在物料守恒:c(A-)+c(HA)=2c(Na+),二者联式可得2c(OH-)+c(A-)=2c(H+)+c(HA),故C正确;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意物料守恒、电荷守恒的灵活运用,弱酸及其强碱盐混合溶液中要根据溶液酸碱性确定酸的电离程度和盐水解程度相对大小,题目难度不大.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | 反应后溶液中铁元素可能以Fe2+形式存在 | |
| B. | 反应后溶液中c(N03-)=0.85 mol/L | |
| C. | 反应后的溶液最多还能溶解1.4 g Fe | |
| D. | 1.12 L气体可能是NO、NO2的混合气体 |
| A. | H+ Na+ S2- CO32- | B. | H+ Ca2+ MnO${\;}_{4}^{-}$ NO${\;}_{3}^{-}$ | ||
| C. | K+ Ca2+ Cl- HCO${\;}_{3}^{-}$ | D. | Cl- Mg2+ Al3+ OH- |
 Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是
Cu2O是一种砖红色固体,在生产中长做半导体材料,可以通过电解方法进行制取,如图所示,总反应式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑.下列说法正确的是( )
| A. | 铜做阳极、石墨做阴极,石墨电极上产生氧气 | |
| B. | 铜电极发生的反应为:2Cu-2e-+2OH-=Cu2O+H2O | |
| C. | 在电解过程中OH-向石墨电极移动 | |
| D. | 当有0.1 mol电子转移时,有0.1 mol Cu2O生成 |
| A. | 整个过程中,H20的电离度逐渐增大 | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(0H-) | ||
| C. | c(Na+)+c(H+)═c(0H-)+c(HS-)+2c(S2-) | D. | c(Na+)═c(HS-)+c(H2S) |
| A. | 22.4LCO中一定含有6.02×1023个分子 | |
| B. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| C. | 常温常压下,16gO2与16gO3含有的分了数相同 | |
| D. | 0.1mol/LK2SO4溶液中含有K+为0.2NA |
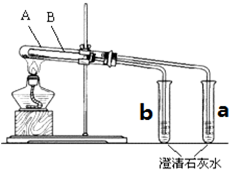 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.