题目内容
14.下列化学用语或物质结构的表述正确的是( )| A. | 中子数为10 的氧原子:10O | |
| B. | 过氧化氢的电子式:H-O-O-H | |
| C. | CS2中各原子最外层都满足8 电子结构 | |
| D. | CH2Cl2是四面体构型的含非极性健的分子 |
分析 A.中子数为10 的氧原子,质量数为10+8=18;
B.H-O-O-H为结构式;
C.根据化合物中元素的化合价以及原子最外层电子数判断;
D.分子中含有C-H、C-Cl键.
解答 解:A.中子数为10 的氧原子,质量数为10+8=18,应为18O,故A错误;
B.过氧化氢的电子式为 ,故B错误;
,故B错误;
C.CS2中,C原子的原子核外最外层电子数为4,其在分子中的化合价为+4价,在分子中的原子最外层电子数为8,故C正确;
D.分子中含有C-H、C-Cl键,都为极性键,故D错误.
故选C.
点评 本题考查较为综合,涉及核素、电子式、核外电子排布以及共价键等知识,为高考常见题型和高频考点,侧重考查双基的掌握,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
5.下列对一些实验事实及其理论解释都正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | Be原子的第一电离能小于B原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CH4为正四面体形分子 | CH4分子中C为sp3杂化,键角为109°28′ |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点高于HCl | HF分子间能形成氢键,HCl不能 |
| A. | A | B. | B | C. | C | D. | D |
9.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{通电}{→}$Al | |
| B. | NH3$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{CO_{2}}{→}$H2SiO3 |
19.为探究NO3-的性质,某实验小组学生进行下列系列实验探究,请按要求回答下列问题.
【查阅资料】活泼金属与1mol/L稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原.
(l)实验I:生成NH4+电极反应式是NO3-+8e-+10 H+=NH4++3H2O;
(2)实验Ⅱ:电子流向:电子Mg电极经导线到Al极.
(3)实验Ⅲ:观察到的现象是电流计指针向右偏转,Mg电极上有无色气体产生,负极反应式为Al-3e-+4OH-=AlO2-+2H2O.
(4)实验IV:推测B中气体成分可能为NH3、H2.
【系列二】向盛有2mL 0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方气体无色,接近瓶口处显浅棕色.
(5)学生甲推测是NO3-氧化SO2,他的推测证据是溶液中有沉淀产生、接近瓶口处显浅棕色.
(6)学生乙则推测是溶液中溶解的O2也氧化了SO2,且设计了如下实验证明了自己的推测正确:向2mL0.1mol/LBaCl2溶液中缓慢通入SO2,若观察到现象:试管内有白色沉淀产生,则乙推测成立.
(7)分别用0.1mol/LBa(NO3)2、O2氧化等量的SO2,消耗二者物质的量之比为2:1.
| 【系列一】实验 | 溶液X | 实验现象 | |
| 实验Ⅰ | 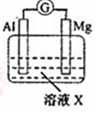 | 1mol/L稀硝酸 | 观察到电流计指针向左偏转. |
| 实验Ⅱ | 6mol/L稀硝酸 | 观察到电流计指针向左偏转,铝片表面产生无色气体,在液面上方变为红棕色 | |
| 实验Ⅲ | 6mol/LNaOH溶液 | 观察到(现象写在答题处). | |
| 实验Ⅳ | 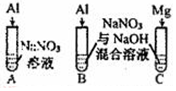 | A、C中均无明显现象,B中有无色气体生成. | |
(l)实验I:生成NH4+电极反应式是NO3-+8e-+10 H+=NH4++3H2O;
(2)实验Ⅱ:电子流向:电子Mg电极经导线到Al极.
(3)实验Ⅲ:观察到的现象是电流计指针向右偏转,Mg电极上有无色气体产生,负极反应式为Al-3e-+4OH-=AlO2-+2H2O.
(4)实验IV:推测B中气体成分可能为NH3、H2.
【系列二】向盛有2mL 0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方气体无色,接近瓶口处显浅棕色.
(5)学生甲推测是NO3-氧化SO2,他的推测证据是溶液中有沉淀产生、接近瓶口处显浅棕色.
(6)学生乙则推测是溶液中溶解的O2也氧化了SO2,且设计了如下实验证明了自己的推测正确:向2mL0.1mol/LBaCl2溶液中缓慢通入SO2,若观察到现象:试管内有白色沉淀产生,则乙推测成立.
(7)分别用0.1mol/LBa(NO3)2、O2氧化等量的SO2,消耗二者物质的量之比为2:1.
18.下列实验“实验操作和现象”与“结论”都正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 分别测定饱和NaClO溶液与饱和CH3COONa溶液的pH,pH(NaC1O)>pH(CH3COONa) | ClO-结合H+的能力比 CH3COO- 的强 |
| B | 25℃时,向pH等于2的醋酸溶液中加入少量0.0lmol•L-1的稀盐酸,溶液的pH会变小 | 醋酸的电离程度增大 |
| C | 将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 氧化性:H2O2>Fe3+ |
| D | 向2mL2%NaOH溶液中加入lmLl%CuSO4溶液,振荡后滴加0.5mL5%葡萄糖溶液,加热至沸腾,出现红色沉淀 | 葡萄糖中含有醛基 |
| A. | A | B. | B | C. | C | D. | D |
19.设NA为阿伏伽徳罗常数的值.下列有关叙述错误的是( )
| A. | 100g质量分数为46%的乙醇水溶液中氧原子数为4NA | |
| B. | 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2 NA | |
| C. | 标准状况下,2.24LD2中所含中子的数目是0.2NA | |
| D. | 25℃时,KSP(BaSO4)=l×10-10,则BaSO4饱和溶液中Ba2+数目为l×10-5NA |
 .
.