题目内容
16.A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀.请填写下列空白: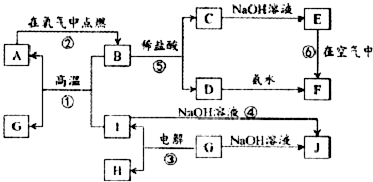
(1)A、B、C、D、E、F六种物质中所含的同一种元素是Fe(写元素符号).
(2)写出物质C、G的化学式:CFeCl2,GAl2O3.
(3)反应①的反应类型是:置换反应(填基本反应类型).
(4)反应④的离子方程式:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(5)检验溶液D中金属阳离子的常用方法是:取少量FeCl3溶液于试管中,加入KCSN溶液,溶液显红色,证明含有Fe3+.
分析 F是红褐色难溶于水的沉淀,则F为Fe(OH)3,结合转化关系可知,A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,G是一种两性氧化物,能与氢氧化钠溶液反应生成J,且I与能与氢氧化钠溶液反应生成G,电解G得到I与H,反应①为铝热反应,则I是Al,H是O2,G为Al2O3,J是NaAlO2,据此解答.
解答 解:F是红褐色难溶于水的沉淀,则F为Fe(OH)3,结合转化关系可知,A为Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,G是一种两性氧化物,能与氢氧化钠溶液反应生成J,且I与能与氢氧化钠溶液反应生成G,电解G得到I与H,反应①为铝热反应,则I是Al,H是O2,G为Al2O3,J是NaAlO2.
(1)A、B、C、D、E、F六种物质中所含的同一种元素是Fe元素,故答案为:Fe;
(2)由上述分析可知,C为FeCl2,G是Al2O3,故答案为:FeCl2;Al2O3;
(3)反应①是高温下铝和四氧化三铁反应生成氧化铝和铁,属于置换反应,故答案为:置换反应;
(4)反应④是铝和氢氧化钠反应生成偏铝酸钠和氢气,其离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(5)检验FeCl3溶液中金属阳离子的常用方法是:取少量FeCl3溶液于试管中,加入KCSN溶液,溶液显红色,证明含有Fe3+,
故答案为:取少量FeCl3溶液于试管中,加入KCSN溶液,溶液显红色,证明含有Fe3+.
点评 本题考查无机物的推断,涉及铁、Al元素元素单质化合物性质,“F的颜色及I、G能与氢氧化钠反应”是推断突破口,再结合转化关系推断,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列比较不能用元素周期律解释的是( )
| A. | 稳定性:HI<HBr<HCl<HF | B. | 元素非金属性:Si<P<S<Cl | ||
| C. | 沸点:正丁烷>异丁烷>丙烷 | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
7.下列有关阿伏加罗常数的值NA的说法错误的是( )
| A. | 32g氧气和臭氧的混合气体中所含的原子数为2NA | |
| B. | 常温常压下,22.4LCO2含有的分子数目为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移的电子数为0.2NA | |
| D. | 0.1mol OH-含有NA个电子 |
4.下列各组物质的分类正确的是( )
| A. | 同位素:14C与14N | |
| B. | 同系物:丙烷、异丁烷、新戊烷 | |
| C. | 电解质:冰醋酸、水银、烧碱 | |
| D. | 酸性氧化物:一氧化氮﹑二氧化碳、三氧化硫 |
11.向含a mol氯化铝的溶液中加入含b mol氢氧化钾溶液,生成沉淀物质的量可能是( )
①a mol ②b mol ③a/3mol ④b/3mol ⑤0mol ⑥(4a-b) mol.
①a mol ②b mol ③a/3mol ④b/3mol ⑤0mol ⑥(4a-b) mol.
| A. | ①②③ | B. | ①②④⑤ | C. | ①②④⑤⑥ | D. | ①③④⑤⑥ |
1.下列化学用语表示正确的是( )
| A. | 过氧化钠的化学式:Na2O | |
| B. | 氯化钙化学式:CaCl | |
| C. | 铝的原子结构示意图: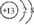 | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
8.已知,E(N≡N )=945kJ•mol-1,EH-H=436kJ•mol-1,EN-H=391kJ•mol-1.那么1mol N2与3mol H2合成氨时的能量变化为( )
| A. | 吸收208 kJ的热量 | B. | 放出208 kJ的热量 | ||
| C. | 吸收93 kJ的热量 | D. | 放出93 kJ的热量 |
5.下列说法正确的是( )
| A. | 已知X在一定条件下转化为Y,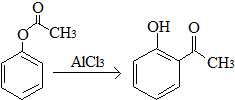 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 ,X与Y互为同分异构体,可用FeCl3溶液鉴别 | |
| B. | 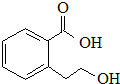 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、水解反应 | |
| C. | 淀粉、蛋白质最终的水解产物都只有一种 | |
| D. | 香柠檬粉具有抗氧化功能,结构为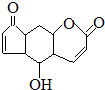 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH 它与溴水发生反应,1mol最多消耗3molBr2,它与NaOH溶液反应,1mol最多消耗2molNaOH |
6.下列有关热化学方程式的叙述正确的是( )
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的标准燃烧热为-483.6kJ/mol | |
| B. | △H的数值与化学反应方程式的化学计量系数无关 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 己知C(s)+O2(g)═CO2(g)△H1;C(g)+O2(g)═CO2(g)△H2,则△H1<△H2 |