题目内容
5.Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,分析溶液中的溶质和可能残留固体不溶物的成分.(1)请完成下列表格
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | FeCl2、CuCl2、FeCl3 | |
| ② | 无 | |
| ③ | FeCl2、CuCl2 | |
| ④ | Cu | |
| ⑤ | Fe、Cu |
| 组别 | ① | ② | ③ | ④ |
| 混合粉末质量/g | 40 | 40 | 40 | 40 |
| FeCl3溶液体积/mL | 150 | 300 | 330 | 350 |
| 反应后剩余固体质量/g | 23.2 | 6.4 | 2.56 | x |
(3)通过计算判断第②组剩余固体的成分.
(4)求原混合粉末中Fe、Cu的物质的量之比.
分析 Ⅰ、根据在金属活动性顺序中,铁在铜的前面,铁能与铜盐溶液发生置换反应,向装有氯化铁溶液的烧杯中,加入一定量的Cu和Fe的混合粉末,则铁优先与氯化铁发生反应生成氯化亚铁,然后铜与氯化铁反应生成氯化铜和氯化亚铁进行解答;
Ⅱ、(2)第④组实验,可以看作再第②组实验的基础上再加入50mL FeCl3溶液,发生Cu+2Fe3+=Fe2++Cu2+,根据方程式计算50mL溶液可以溶解Cu的质量,进而计算x的值;
(3)铁的还原性强于铜,所以Fe3+先和铁反应:Fe+2Fe3+=3Fe2+,反应完全后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=Fe2++Cu2+,能剩余的固体可以是铜,可以是铁和铜,
第②组实验中,有固体剩余,故FeCl3溶液全部参与反应,若只发生Fe+2Fe3+=3Fe2+,可以溶解Fe的质量为0.3L×4mol/L×$\frac{1}{2}$×56g/mol=33.6g,300mL FeCl3溶液能溶解金属质量40g-6.4g=33.6g,
第③组实验,可以看作再第②组实验的基础上再加入30mL FeCl3溶液,实际溶解金属质量=6.4g-2.56g=3.84g,若只发生Fe+2Fe3+=3Fe2+,30mL溶液可以溶解Fe的质量为0.03L×4mol/L×$\frac{1}{2}$×56g/mol=3.36g,若只发生Cu+2Fe3+=Fe2++Cu2+,30mL溶液可以溶解Cu的质量为0.03L×4mol/L×$\frac{1}{2}$×64g/mol=3.84g,可推断第②组实验中Fe恰好反应完全,剩余固体为Cu;
(4)根据(3)中分析可知Cu为6.4g,进而计算Fe的质量,再根据n=$\frac{m}{M}$计算Fe、Cu的物质的量,进而计算二者物质的量之比.
解答 解:Ⅰ、(1)在金属活动性顺序中,铁在铜的前面,铁能与铜盐溶液发生置换反应,向装有氯化铁溶液的烧杯中,加入一定量的Cu和Fe的混合粉末,则铁优先与氯化铁发生反应生成氯化亚铁,然后铜与氯化铁反应生成氯化铜和氯化亚铁,故滤液中一定含有氯化亚铁,若氯化铁与铁是恰好完全反应,则铜不参加反应,滤液中不含有氯化铜,故氯化铜可能存在,充分反应后发现烧杯底部仍有少量固体,则固体中一定含有铜,若铁量多,可能含有铁,有铜存在,则滤液中一定不含有氯化铁;
故答案为:
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | 无 | |
| ② | FeCl2、CuCl2 | |
| ③ | Cu | |
| ④ | FeCl2 | |
| ⑤ | FeCl2 |
故答案为:0; 2Fe3++Fe=3Fe2+;
(3)铁的还原性强于铜,所以Fe3+先和铁反应:Fe+2Fe3+=3Fe2+,反应完全后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=Fe2++Cu2+,能剩余的固体可以是铜,可以是铁和铜,
第②组实验中,有固体剩余,故FeCl3溶液全部参与反应,若只发生Fe+2Fe3+=3Fe2+,可以溶解Fe的质量为0.3L×4mol/L×$\frac{1}{2}$×56g/mol=33.6g,300mL FeCl3溶液能溶解金属质量40g-6.4g=33.6g,
第③组实验,可以看作再第②组实验的基础上再加入30mL FeCl3溶液,实际溶解金属质量=6.4g-2.56g=3.84g,若只发生Fe+2Fe3+=3Fe2+,30mL溶液可以溶解Fe的质量为0.03L×4mol/L×$\frac{1}{2}$×56g/mol=3.36g,若只发生Cu+2Fe3+=Fe2++Cu2+,30mL溶液可以溶解Cu的质量为0.03L×4mol/L×$\frac{1}{2}$×64g/mol=3.84g,可推断第②组实验中Fe恰好反应完全,剩余固体为Cu,
答:第②组剩余固体的成分为Cu;
(4)根据(3)中分析可知Cu为6.4g,Fe的质量=40g-6.4g=33.6g,故n(Fe)=$\frac{33.6g}{56g/mol}$=0.6mol,n(Cu)=$\frac{6.4g}{64g/mol}$=0.1mol,原混合粉末中Fe、Cu的物质的量之比=0.6mol:0.1mol=6:1,
答:原混合粉末中Fe、Cu的物质的量之比6:1.
点评 本题考查了混合物的有关计算、铁及其化合物的性质应用,关键是通过②判断剩余固体为铜,题目综合性较大,数据较复杂,侧重学生对实验数据的分析处理考查,难度较大.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案| A. | K+、SO42-、I-、NO3- | B. | Cu2+、Na+、Cl-、S2- | ||
| C. | Ca2+、K+、HCO3-、NO3- | D. | K+、Na+、CH3COO-、Br- |
| A. | KCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | 向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液:c(Na+)>c(F-)>c(H+)>c(OH-) | |
| C. | 25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌反应,相同时间内HA与Zn反应生成的氢气更多,HA是弱酸 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
| A. | 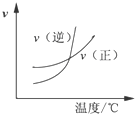 某可逆反应的正反应是吸热反应 | B. | 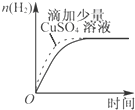 等量的锌粉与足量的盐酸反应 | ||
| C. | 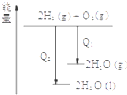 氯气和氧气反应中的能量变化 | D. | 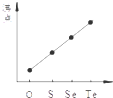 气态氢化物沸点 |
| A. |  容量瓶 | B. |  蒸馏烧瓶 | C. |  蒸发皿 | D. |  滴定管 |
| A. | 按I-、Fe2+、Br-的顺序还原性逐渐减弱 | |
| B. | 通入氯气后原溶液中Fe2+一定被氧化 | |
| C. | 原溶液中Br-一定被氧化 | |
| D. | 不能确定通入氯气后的溶液中是否还存在Fe2+ |
| A. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | CH3CH2Br+NaOH$\stackrel{H_{2}O}{→}$CH3CH2OH+NaBr | |
| D. | 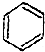 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$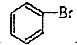 +HBr +HBr |