题目内容
20.下列图象表达正确的是( )| A. | 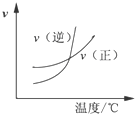 某可逆反应的正反应是吸热反应 | B. | 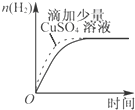 等量的锌粉与足量的盐酸反应 | ||
| C. | 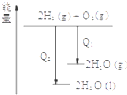 氯气和氧气反应中的能量变化 | D. | 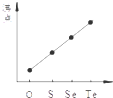 气态氢化物沸点 |
分析 A、吸热反应,升高温度,平衡正向移动,正反应速率大于逆反应速率;
B、等量的锌粉与足量的盐酸过程中,加入硫酸铜可以构成原电池,加快反应速率,但是金属锌被消耗置换出了金属铜;
C、液态水转化为气态水的过程是吸热的;
D、同主族元素单质从上到下,得到气态氢化物的沸点随着分子量的增加而增大,但是存在氢键物质沸点较高.
解答 解:A、反应是吸热反应,升高温度,平衡正向移动,正反应速率大于逆反应速率,和图象不符,故错误;
B、等量的锌粉与足量的盐酸过程中,加入硫酸铜可以构成原电池,加快反应速率,但是金属锌被消耗置换出了金属铜,所以产生氢气的量会减少,故错误;
C、液态水转化为气态水的过程是吸热的,氢气燃烧生成液态水释放的热量高于生成气态水释放的热量,故C正确;
D、同主族元素单质从上到下,得到气态氢化物的沸点随着分子量的增加而增大,但是存在水分子中存在氢键,物质沸点最高,故D错误.
故选C.
点评 本题涉及反应热、影响反应速率的因素以及平衡移动等知识,属于综合知识的考查,难度中等.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
11.下列离子方程式书写正确的是( )
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-→Mg(OH)2↓ | |
| B. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32--+H2O?HCO3-+OH- | |
| C. | 向Ca(HCO3)2溶液中滴加过量的NaOH溶液:Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H2O | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+→Fe3++3H2O |
8.下列叙述正确的是( )
| A. | 漂白粉、水玻璃、冰醋酸、聚乙烯都是混合物 | |
| B. | 金属氧化物一定是碱性氧化物 | |
| C. | 胶体区别于其他分散系的本质特征是胶体粒子直径介于1~100nm之间 | |
| D. | 淀粉、油脂和蛋白质都属于天然高分子化合物 |
15. 研究人员研制出一种可在一分钟内完成充放电的超长性能铝离子电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如图所示.下列说法正确的是( )
研究人员研制出一种可在一分钟内完成充放电的超长性能铝离子电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如图所示.下列说法正确的是( )
 研究人员研制出一种可在一分钟内完成充放电的超长性能铝离子电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如图所示.下列说法正确的是( )
研究人员研制出一种可在一分钟内完成充放电的超长性能铝离子电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如图所示.下列说法正确的是( )| A. | 放电时,电子由石墨(Cn)电极经用电器流向铝电极 | |
| B. | 放电时,有机阳离子向铝电极方向移动 | |
| C. | 充电时,铝电极上发生氧化反应 | |
| D. | 放电时,负极的电极反应为:Al-3e-+7AlCl4-═4Al2Cl7- |
5.Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,分析溶液中的溶质和可能残留固体不溶物的成分.
(1)请完成下列表格
Ⅱ.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某课外活动小组同学的实验结果如下(假定反应前后溶液体积不变).
(2)试判断第④组剩余固体质量x为0.第②组实验中,发生反应的离子方程式为2Fe3++Fe=3Fe2+.
(3)通过计算判断第②组剩余固体的成分.
(4)求原混合粉末中Fe、Cu的物质的量之比.
(1)请完成下列表格
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | FeCl2、CuCl2、FeCl3 | |
| ② | 无 | |
| ③ | FeCl2、CuCl2 | |
| ④ | Cu | |
| ⑤ | Fe、Cu |
| 组别 | ① | ② | ③ | ④ |
| 混合粉末质量/g | 40 | 40 | 40 | 40 |
| FeCl3溶液体积/mL | 150 | 300 | 330 | 350 |
| 反应后剩余固体质量/g | 23.2 | 6.4 | 2.56 | x |
(3)通过计算判断第②组剩余固体的成分.
(4)求原混合粉末中Fe、Cu的物质的量之比.
12.下列说法正确的是( )
| A. | 煤、石油、沼气属于人类利用的主要化石燃料 | |
| B. | 煤干馏是复杂的物理化学变化,可得到焦炭、煤焦油和焦炉煤气等 | |
| C. | 氢气是一种清洁能源 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
9.已知H2SO3+I2+H2O=H2SO4+2HI,将0.1molCl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是( )
| A. | 物质的还原性:HI>H2SO3>HCl | |
| B. | HI与H2SO3的物质的量浓度为0.6 mol•L-1 | |
| C. | 通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O=4SO42-+I2+10Cl-+16H+ | |
| D. | 若再通入0.05molCl2,恰好能将HI和H2SO3完全氧化 |
12.将铝粉,石墨,二氧化钛按一定比例混合均匀,涂在金属表面,在高温下煅烧:4Al+3C+3TiO2=3TiC+2Al2O3
留在金属表面的涂层是一种高温金属陶瓷,广泛应用于火箭和导弹技术中.关于该反应,说法正确的是( )
留在金属表面的涂层是一种高温金属陶瓷,广泛应用于火箭和导弹技术中.关于该反应,说法正确的是( )
| A. | TiC中钛元素-4价 | B. | 每生成1molTiC转移电子4mol | ||
| C. | TiO2是氧化剂,Al,C是还原剂 | D. | TiC不属于新型无机非金属材料 |
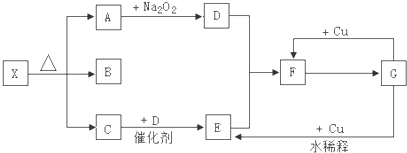
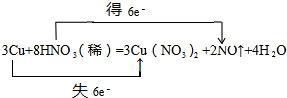 .
.