题目内容
13.下列有关电解质溶液的说法正确的是( )| A. | KCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | 向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液:c(Na+)>c(F-)>c(H+)>c(OH-) | |
| C. | 25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌反应,相同时间内HA与Zn反应生成的氢气更多,HA是弱酸 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
分析 A.醋酸铵溶液中,醋酸根离子和铵根离子水解,促进了水的电离,而钾离子和氯离子不影响水的电离;
B.该离子浓度关系违反了电荷守恒;
C.锌足量时,生成氢气的量越多,说明该酸的浓度越大,而pH相等,则该酸的酸性较弱;
D.碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,溶液的碱性增强、pH增大.
解答 解:A.CH3COONH4促进水的电离,KCl对水的电离无影响,所以两溶液中水的电离程度不同,故A错误;
B.向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液,则c(H+)>c(OH-),根据电荷守恒可知,c(F-)>c(Na+),故B错误;
C.25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌反应,相同时间内HA与Zn反应生成的氢气更多,由于都是一元酸,则pH相同时HA的浓度较大,说明HA的酸性小于HB,则HA是弱酸,故C正确;
D.Na2CO3溶液中加入少量Ca(OH)2固体,反应生成碳酸钙沉淀和NaOH,溶液中氢氧根离子浓度增大,则溶液的pH增大,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及水的电离及其影响、酸性强弱判断、离子浓度大小比较等知识,注意电荷守恒的含义及在判断离子浓度大小中的应用方法,试题培养留学生的分析能力及灵活应用能力.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
4.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 0oC,1.01×106Pa时,11.2L氧气所含的氧原子数为NA | |
| B. | 标准状况下,80gSO3所占的体积约为22.4L | |
| C. | 31g白磷分子中,含有的共价单键数目是NA | |
| D. | 0.5 mol Na2O2中含有的阴离子数为0.5NA |
1.不能通过相应氧化物进一步与氧气反应生成的物质是( )
| A. | SO3 | B. | H2O2 | C. | NO2 | D. | Na2O2 |
8.下列叙述正确的是( )
| A. | 漂白粉、水玻璃、冰醋酸、聚乙烯都是混合物 | |
| B. | 金属氧化物一定是碱性氧化物 | |
| C. | 胶体区别于其他分散系的本质特征是胶体粒子直径介于1~100nm之间 | |
| D. | 淀粉、油脂和蛋白质都属于天然高分子化合物 |
18.下列固体物质中阴阳离子的个数比不是1:1的是( )
| A. | NaHCO3 | B. | Na2O2 | C. | NaOH | D. | CaC2 |
5.Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,分析溶液中的溶质和可能残留固体不溶物的成分.
(1)请完成下列表格
Ⅱ.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某课外活动小组同学的实验结果如下(假定反应前后溶液体积不变).
(2)试判断第④组剩余固体质量x为0.第②组实验中,发生反应的离子方程式为2Fe3++Fe=3Fe2+.
(3)通过计算判断第②组剩余固体的成分.
(4)求原混合粉末中Fe、Cu的物质的量之比.
(1)请完成下列表格
| 序号 | 溶液中的盐 | 固体不溶物的成分 |
| ① | FeCl2、CuCl2、FeCl3 | |
| ② | 无 | |
| ③ | FeCl2、CuCl2 | |
| ④ | Cu | |
| ⑤ | Fe、Cu |
| 组别 | ① | ② | ③ | ④ |
| 混合粉末质量/g | 40 | 40 | 40 | 40 |
| FeCl3溶液体积/mL | 150 | 300 | 330 | 350 |
| 反应后剩余固体质量/g | 23.2 | 6.4 | 2.56 | x |
(3)通过计算判断第②组剩余固体的成分.
(4)求原混合粉末中Fe、Cu的物质的量之比.
2.下列属于电解质的是( )
| A. | Cu | B. | 熔融的K2SO4 | C. | 乙醇 | D. | NaOH溶液 |
 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题: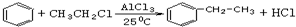
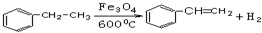 ;试以乙烯、苯、食盐、水等为原料制备苯乙醇 (
;试以乙烯、苯、食盐、水等为原料制备苯乙醇 (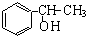 ),写出各步反应的化学方程式:
),写出各步反应的化学方程式: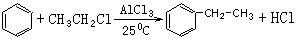 ;
;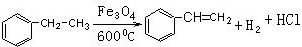 ;
;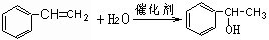 .
.