题目内容
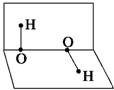 已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中不正确的是( )
已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中不正确的是( )| A、分子的正、负电荷重心不重合 |
| B、H2O2分子内既含极性键又含非极性键 |
| C、H2O2是极性分子 |
| D、H2O2分子间不可能形成氢键 |
考点:过氧化氢
专题:
分析:A.根据图象知,双氧水分子的正负电荷重心不重合;
B.H202氧原子和氧原子之间形成的是非极性共价键;
C.正负电荷重心不重合的分子为极性分子;
D.氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用,称为氢键.
B.H202氧原子和氧原子之间形成的是非极性共价键;
C.正负电荷重心不重合的分子为极性分子;
D.氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间或分子内相互作用,称为氢键.
解答:
解:A.双氧水分子空间构型是二面角构型,所以正负电荷重心不重合,故A正确;
B.H202是共价化合物,氢原子与氧原子之间形成的是极性共价键,氧原子和氧原子之间形成的是非极性共价键,故B正确;
C.根据图象知,该分子正负电荷重心不重合,为极性分子,故C正确;
D.H2O2分子中羟基上 氢原子与另一个分子的氧原子可能形成氢键,故D错误;
故选D.
B.H202是共价化合物,氢原子与氧原子之间形成的是极性共价键,氧原子和氧原子之间形成的是非极性共价键,故B正确;
C.根据图象知,该分子正负电荷重心不重合,为极性分子,故C正确;
D.H2O2分子中羟基上 氢原子与另一个分子的氧原子可能形成氢键,故D错误;
故选D.
点评:本题考查了分子极性、化学键的判断,为高考频点,根据其空间构型分析解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于物质分类的正确组合是( )
 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Na2O | CO |
| C | NaOH | CH3COOH | MgCl2 | CO2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A、A | B、B | C、C | D、D |
下列分子式表示的物质一定是纯净物的是( )
| A、CH2O |
| B、C2H6O |
| C、C3H7Cl |
| D、C2H4Cl2 |