题目内容
芒硝化学式为Na2SO4?10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.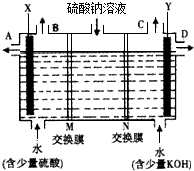
①该电解槽的阳极反应式为 .此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②制得的氢氧化钠溶液从出口(填写“A”、“B”、“C”或“D”) 导出.
③通电开始后,阴极附近溶液pH会增大,请简述原因: .
④已知H2的燃烧热为285.8kJ/mol,则该燃料电池工作产生36gH2O时,理论上有 kJ的能量转化为电能.

①该电解槽的阳极反应式为
②制得的氢氧化钠溶液从出口(填写“A”、“B”、“C”或“D”)
③通电开始后,阴极附近溶液pH会增大,请简述原因:
④已知H2的燃烧热为285.8kJ/mol,则该燃料电池工作产生36gH2O时,理论上有
考点:电解原理,有关燃烧热的计算
专题:
分析:①电解时,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,阳极上失电子发生氧化反应;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;
②根据氢氧化钠生成的电极判断导出口;
③根据放电的离子判断PH增大的原因;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子;结合燃烧热方程式及电池反应计算.
②根据氢氧化钠生成的电极判断导出口;
③根据放电的离子判断PH增大的原因;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子;结合燃烧热方程式及电池反应计算.
解答:
解:①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,故答案为:4OH--4e-=2H2O+O2↑;小于;
②氢氧化钠在阴极生成,所以在D口导出;故答案为:D;
③通电开始后,阴极上氢离子放电生成氢气,氢离子来自于水,所以促进水的电离,导致溶液中氢氧根离子的浓度大于氢离子的浓度,所以溶液的PH值增大.
故答案为:H+放电,促进水的电离,OH-浓度增大;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子,H2的燃烧热为285.8kJ/mol,则2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,该燃料电池工作产生36g H2O,n(H2O)=
=2mol,由燃烧的热方程式可知,生成2molH2O放出571.6kJ的热量,即理论上有571.6kJ的能量转化为电能,
故答案为:571.6.
②氢氧化钠在阴极生成,所以在D口导出;故答案为:D;
③通电开始后,阴极上氢离子放电生成氢气,氢离子来自于水,所以促进水的电离,导致溶液中氢氧根离子的浓度大于氢离子的浓度,所以溶液的PH值增大.
故答案为:H+放电,促进水的电离,OH-浓度增大;
④氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,负极上氢气失去电子,H2的燃烧热为285.8kJ/mol,则2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol,该燃料电池工作产生36g H2O,n(H2O)=
| 36g |
| 18g/mol |
故答案为:571.6.
点评:本题考查了原电池和电解池原理,难度不大,注意燃料原电池电极反应式的书写时,要根据电解质溶液的酸碱性确定生成的离子或物质.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
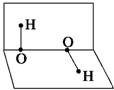 已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中不正确的是( )
已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中不正确的是( )| A、分子的正、负电荷重心不重合 |
| B、H2O2分子内既含极性键又含非极性键 |
| C、H2O2是极性分子 |
| D、H2O2分子间不可能形成氢键 |
一个原电池的总反应的离子方程式是Zn+Cu2+═Zn2++Cu,该原电池的合理组成是( )
| 正极 | 负极 | 电解质溶液 | |
| A | Zn | Cu | CuCl2 |
| B | Cu | Zn | H2SO4 |
| C | Cu | Zn | CuSO4 |
| D | Zn | Fe | CuCl2 |
| A、A | B、B | C、C | D、D |
用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
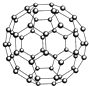

| A、28 g N60单质(见如图)中含有的N-N键键数为3NA |
| B、常温常压下,28 g C2H4和C3H6的混合气体中含有碳原子的数目为2NA |
| C、一定温度下,1 L0.5mol/L 的NH4Cl溶液与2 L 0.25 moL/L NH4Cl溶液含NH4+数目相等 |
| D、含有2NA个阴离子的CaC2在标准状况下,能产生约44.8L的乙炔气体 |
 钾的化学性质非常活泼在氧气中燃烧能生成 超氧化钾晶体(KO2),其结构如图所示为该晶体的一个晶胞(晶体中最小重复单元).下列有关说法正确的是( )
钾的化学性质非常活泼在氧气中燃烧能生成 超氧化钾晶体(KO2),其结构如图所示为该晶体的一个晶胞(晶体中最小重复单元).下列有关说法正确的是( )| A、晶体中所有原子间都以离子键结合 |
| B、晶体中与每个K+距离最近且相等的O2-有6个,距离最近且相等的K+有12个 |
| C、该晶体的化学式为KO2,则每个晶胞中只有1个K+和1个O2- |
| D、该晶体中阴阳离子个数之比为2:1 |
 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.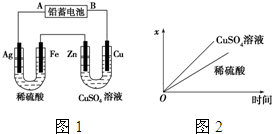 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO2
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO2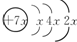 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题: