题目内容
10.下列实验操作或装置正确的是( )| A. | 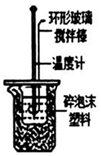 用图所示装置测定中和反应的反应热 | |
| B. |  用图所示装置在实验室制取少置乙烯 | |
| C. | 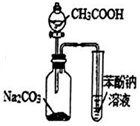 用图3所示装置证明碳酸酸性强于苯酚 | |
| D. | 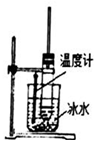 用图所示装置在实验室制取少量硝基苯 |
分析 A.图中装置可测定反应的温度;
B.乙醇在170℃发生消去反应生成乙烯,应测定反应液的温度;
C.醋酸挥发,醋酸与苯酚钠反应;
D.制取硝基苯,控制温度为50~60℃,水浴加热.
解答 解:A.图中装置可测定反应的温度,则可测定中和反应的反应热,故A正确;
B.乙醇在170℃发生消去反应生成乙烯,应测定反应液的温度,则图中温度计的水银球应在液面下,故B错误;
C.醋酸挥发,醋酸与苯酚钠反应,则不能比较碳酸、苯酚的酸性,故C错误;
D.制取硝基苯,控制温度为50~60℃,水浴加热,不能选冰水,温度计测定水温,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质、制备实验、中和热测定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
20.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1;W的质子数是X、Y、Z、M四种元素质子数之和的$\frac{1}{2}$.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线型的共价化合物 | |
| C. | 由X元素形成的单质可能导电 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
1.下列有关物质用途的说法正确的是( )
| A. | 碳酸钠用于治疗胃酸过多 | B. | 稀硫酸用于除铁锈 | ||
| C. | 晶体硅用于制造光导纤维 | D. | 硫酸钡用于制作石膏绷带 |
18.下列对生活中有关化学问题的分析正确的是( )
| A. | 钙和磷都是人体内含量丰富的矿物元素,它们都属于微量元素 | |
| B. | 垃圾焚烧和发电技术的结合,既解决了污染问题,又有效利用了垃圾所含的能量 | |
| C. | 制造普通玻璃的主要反应原理之一为:CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$=CaSiO3 | |
| D. | 青霉素是最早发现的天然抗生素,其中起治疗作用的是水杨酸 |
15.下列物质性质与应用对应关系不正确的是( )
| 性质 | 应用 | |
| A | 铁比铜金属性强 | 可用FeCl3溶液腐蚀Cu制印刷电路板 |
| B | 活性炭具有吸附性 | 可用活性炭去除冰箱中的异味 |
| C | 油污在一定条件下会发生水解反应 | 可用热的纯碱溶液清除炊具上的油污 |
| D | 氢氟酸能与二氧化硅反应 | 可用氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
2.高铁酸钾是一种常用的水处理剂.工业制备高铁酸钾的离子反应式为:Fe3++C1O-+OH-→FeO42-+C1-+H2O
下列有关说法不正确的是( )
下列有关说法不正确的是( )
| A. | 高铁酸钾中铁显+6价 | |
| B. | Fe3+的氧化性强于FeO42- | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为3:2 | |
| D. | 用K2FeO4处理废水时其转化为Fe3+,因此K2FeO4具有杀菌和吸附双重作用 |
19.设NA表示阿伏加徳罗常数的数值,下列说法正确的是( )
| A. | CO2通过Na2O2使其增重28 g 时,反应中转移的电子数为0.5NA | |
| B. | 25℃时,Ksp(BaSO4)=1×10-10,则 Ba SO4饱和溶液中Ba2+数目为=1×10-5 NA | |
| C. | 标准状况下,22.4 L CH2Cl2中共价键的数目为4NA | |
| D. | 高温下,16.8g Fe与足量的水蒸气完全反应失去电子的数目为0.8NA |
14.在25℃时,由水电离出的c(H+)为1×10-12mol•L-1,该溶液不可能是( )
| A. | 0.01 mol•L-1的碳酸钠溶液 | B. | pH=12的Ba(OH)2溶液中 | ||
| C. | 0.01 mol•L-1的醋酸 | D. | 0.01 mol•L-1的盐酸 |
 营养均衡是人体健康的保证.
营养均衡是人体健康的保证.