题目内容
14.在25℃时,由水电离出的c(H+)为1×10-12mol•L-1,该溶液不可能是( )| A. | 0.01 mol•L-1的碳酸钠溶液 | B. | pH=12的Ba(OH)2溶液中 | ||
| C. | 0.01 mol•L-1的醋酸 | D. | 0.01 mol•L-1的盐酸 |
分析 根据水电离出的c(H+)=1×10-12 mol/L,水的电离受到抑制,该溶液可能为酸或碱或盐的溶液;据此选择即可.
解答 解:A.由水电离出氢离子的浓度为1×10-12 mol•L-1,水的电离受到抑制,碳酸钠溶液中水的电离受到促进,故A选;
B.由水电离出氢离子的浓度为1×10-12 mol•L-1,水的电离受到抑制,可能为强碱溶液,此时氢离子浓度等于1×10-12,pH=12,可能是pH=12的Ba(OH)2溶液,故B不选;
C.0.01 mol•L-1的醋酸,醋酸电离的氢离子浓度小于0.01 mol•L-1,则水电离出的c(H+)大于1×10-12mol•L-1,故C选;
D.0.01 mol•L-1的盐酸,HCl电离的氢离子浓度等于0.01 mol•L-1,则水电离出的c(H+)=1×10-12mol•L-1,故D不选;
故选AC.
点评 本题考查了pH的有关计算,注意水电离出的氢离子浓度为1×10-12mol/L的溶液,则溶液可能为酸或碱或盐的溶液,明确由水电离出的氢离子浓度及利用该信息来分析问题是解答的关键,难度较小.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
10.下列实验操作或装置正确的是( )
| A. | 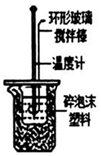 用图所示装置测定中和反应的反应热 | |
| B. |  用图所示装置在实验室制取少置乙烯 | |
| C. | 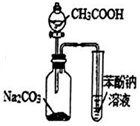 用图3所示装置证明碳酸酸性强于苯酚 | |
| D. | 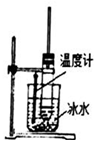 用图所示装置在实验室制取少量硝基苯 |
11.下列物质分类的正确组合是( )
| 混合物 | 化合物 | 单质 | 盐 | |
| A | 盐酸溶液 | NaOH溶液 | 石墨 | 食盐 |
| B | 水玻璃 | KNO3晶体 | O2 | 纯碱(Na2CO3) |
| C | 空气 | 澄清石灰水 | 铁 | 石灰石 |
| D | CuSO4•5H2O | CaCl2 | 水银 | CaO |
| A. | A | B. | B | C. | C | D. | D |
2.现有部分元素的性质与原子(或分子)结构如表:
(1)X形成的双原子分子的结构式为O=O,X形成的氢化物的沸点在同族元素形成的氢化物中是最高(填“最高”或“最低”),原因是水分子间存在氢键.
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是SO2(填化学式),检验该气体的常用试剂品红溶液.
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 地壳中含量最高的非金属元素 |
| Y | M层比K层多1个电子 |
| Z | 最外层电子数为内层电子数的0.6倍 |
| W | 与氯形成的氯化物是生活中常用的调味品 |
(2)金属冶炼Y单质的化学方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-.
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是SO2(填化学式),检验该气体的常用试剂品红溶液.
9.如图装置放置一段时间后,铁钉均被腐蚀.下列有关描述不正确的是( )


| A. | 红墨水水柱两边的液面变为左低右高 | |
| B. | I 和Ⅱ中负极反应式均为 Fe-2e-=Fe2+ | |
| C. | I 中正极反应式为 O2+2H2O+4e-=4OH | |
| D. | Ⅱ中 NH4Cl 溶液里有气泡产生 |
19.下列冇关实验方法或操作正确的( )
| A. |  喷泉实验 | B. |  氯气除杂 氯气除杂 | C. |  分离汽油和水 | D. |  丁达尔效应 |
3.高温条件下,Al和Fe2O3反应生成Fe和Al2O3.下列说法正确的是( )
| A. |  该反应过程中的能量变化如图所示 | |
| B. | 该反应条件下,Al的还原性强于Fe | |
| C. | 反应中每生成1 mol Fe转移6×6.02×1023个电子 | |
| D. | 实验室进行该反应时常加入KClO3作催化剂 |
4.能正确表示下列反应的离子方程式的是( )
| A. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O?Cl2↑+H2↑+2OH- | |
| B. | 向氯化铝溶液中滴加少量Na2CO3溶液:2Al3++3CO32-?Al2(CO3)3↓ | |
| C. | 一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| D. | FeCl3溶液与NaAlO2溶液混合:Fe3++3AlO2-?Fe(AlO2)3↓ |



