题目内容
14.下列有关核外电子排布的式子不正确的是( )| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的简化电子排布式:[Ar]4s1 | |
| C. | N原子的电子排布图: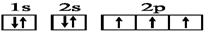 | |
| D. | S原子的电子排布图: |
分析 A.Cr电子排布式:1s22s22p63s23p63d54s1,外围电子排布式为3d54s1;
B.K的电子排布式:1s22s22p63s23p64s1,简化电子排布式:[Ar]4s1;
C.N的电子排布式:1s22s22p3;
D.硫原子的电子排布图中,3p能级中,电子优先占据一个轨道.
解答 解:A.Cr电子排布式:1s22s22p63s23p63d54s1,外围电子排布式为3d54s1,故A正确;
B.K的电子排布式:1s22s22p63s23p64s1,简化电子排布式:[Ar]4s1,故B正确;
C.N的电子排布式:1s22s22p3,所以电子排布图: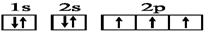 ,故C正确;
,故C正确;
D.硫原子3p能级中的3电子优先占据1个轨道,且自旋方向相同,然后第4个电子占据3p能级的第一个轨道,且自旋方向相反时能量最低,即3p能级电子排布应该为: ,故D错误;
,故D错误;
故选D.
点评 本题考查了原子结构示意图等知识,注意领会能量最低原理、保里不相容原理、洪特规则的内容来是答题的关键,难度不大.

练习册系列答案
相关题目
4.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.2NA | |
| B. | 常温常压下,1 mol CH4中含有的氢原子数为4NA | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |
5.下表是元素周期表的一部分,回答下列问题:
(1)写出①、②两种元素的名称碳,氮;⑧、⑨两种元素的符号SiP.
(2)在这些元素中,Na(用元素符号填写,下同)是最活泼的金属元素;F是最活泼的非金属元素.
(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)写出①的最高价氧化物的化学式CO2
(5)比较⑤与⑥的化学性质,Na更活泼.
| 周期/族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,Na(用元素符号填写,下同)是最活泼的金属元素;F是最活泼的非金属元素.
(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)写出①的最高价氧化物的化学式CO2
(5)比较⑤与⑥的化学性质,Na更活泼.
2.燃烧1g乙炔生成二氧化碳和液态水放出热量50kJ,则下列热化学方程式书写正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+50 kJ•mol-1 | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1 300 kJ | |
| C. | 2C2H2+5O2═4CO2+2H2O△H=-2 600 kJ | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2 600 kJ•mol-1 |
9.表示一个原子在第三个电子层上有10个电子可以写成( )
| A. | 3s10 | B. | 3d10 | C. | 3s23p63d2 | D. | 3s23p53d3 |
19.两种有机物A、B取等质量完全燃烧,生成的CO2与消耗氧气的量分别相同,这两种有机物之间的关系正确的是( )
| A. | 互为同分异构体 | B. | 互为同系物 | C. | 只能是同种物质 | D. | 最简式一定相同 |
6.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③熔点:SO3>SiO2>CO2
④结合质子能力:OH->CH3COO->Cl-.
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③熔点:SO3>SiO2>CO2
④结合质子能力:OH->CH3COO->Cl-.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
3.有一种银锌微型纽扣电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-═ZnO+H2O Ag2O+2H2O+2e-═2Ag+2OH-,电池总反应为:Ag2O+Zn═2Ag+ZnO.下列有关叙述中不正确的是( )
| A. | Zn为负极,Ag2O是正极 | |
| B. | 在使用过程中,电池负极区溶液的c(OH-)值减小 | |
| C. | 电池工作时,电子由Zn极经外电路流向Ag2O极 | |
| D. | 电路中每通过0.2mol电子,负极的质量理论上减少6.5g |