题目内容
4.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.2NA | |
| B. | 常温常压下,1 mol CH4中含有的氢原子数为4NA | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |
分析 A.根据过氧化钠的物质的量和O元素的化合价分析;
B.1 mol CH4中含有4mol氢原子;
C.铁过量时生成硝酸亚铁;
D.NaHSO4=Na++HSO4-.
解答 解:A.7.8g过氧化钠为0.1mol,与足量水反应,自身发生氧化还原反应,转移电子数为0.1NA,故A错误;
B.1 mol CH4中含有4mol氢原子,氢原子数为4NA,故B正确;
C.铁过量时生成硝酸亚铁,5.6g铁与硝酸反应,失去的电子数介于0.2NA~0.3NA,故C错误;
D.NaHSO4=Na++HSO4-,不存在氢离子和硫酸根离子,故D错误.
故选B.
点评 本题考查阿伏加德罗常数,题目难度不大,注意物质的组成、结构、性质、存在条件和物质的聚集状态.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
14.在如图所示的微粒中,氧化性最强的是( )
| A. |  | B. |  | C. |  | D. |  |
19.在一定温度下,反应:2A(g)+2B(g)?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是( )
| A. | A的物质的量浓度不再改变 | |
| B. | 混合气的密度不再随时间而变化 | |
| C. | 容器内的压强不随时间而变化 | |
| D. | 平衡混合气体的平均相对分子质量不再改变 |
9.NaClO是84消毒液的主要成分下列错误的是( )
| A. | 工业制备NaClO可用电解饱和食盐水的方法离子方程式为:Cl-+H2O $\frac{\underline{\;电解\;}}{\;}$ ClO-+H2↑ | |
| B. | 向NaClO溶液中通入少量SO2气体离子方程式为:SO2+3ClO-+2H2O═2HClO+SO42-+Cl- | |
| C. | 在NaClO溶液中可以大量共存的离子有:K+,SO42-,Fe3+,NO3- | |
| D. | 84消毒液不能和洁厕剂混合使用,也不能用pH试纸测其pH值. |
13.下列关于有机物的说法正确的是( )
| A. | 聚丙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 分馏石油得到的各馏分都是纯净物 | |
| C. | C4H10有2种同分异构体 | |
| D. | 蛋白质水解和油脂皂化都是高分子转化成小分子的过程 |
14.下列有关核外电子排布的式子不正确的是( )
| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的简化电子排布式:[Ar]4s1 | |
| C. | N原子的电子排布图: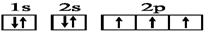 | |
| D. | S原子的电子排布图: |
 .
. .
.