题目内容
5.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z+与Y2-具有相同的电子层结构,W与Y同主族.下列说法正确的是( )| A. | 原子半径大小顺序:W>Z>Y>X | |
| B. | Z在周期表中的位置是第三周期第IA族 | |
| C. | X的气态氢化物的还原性比W的弱 | |
| D. | W比Y更容易与氢气反应 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,Y是地壳中含量最高的元素,则Y为O元素,X原子序数小于Y,
X原子的最外层电子数是其内层电子数的2倍,则X是C元素;
Z+与Y2-具有相同的电子层结构,则Z是Na元素;
W与Y同主族,则W是S元素;
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.Z为Na元素,位于第三周期第IA族;
C.元素的非金属性越强,其氢化物的还原性越弱;
D.元素的非金属性越强,其单质与氢气化合越容易.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,Y是地壳中含量最高的元素,则Y为O元素,X原子序数小于Y,
X原子的最外层电子数是其内层电子数的2倍,则X是C元素;
Z+与Y2-具有相同的电子层结构,则Z是Na元素;
W与Y同主族,则W是S元素;
A.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,X、Y、Z、W原子电子层数依次是2、2、3、3,且原子序数X<Y、Z<W,所以原子半径Z>W>X>Y,故A错误;
B.Z为Na元素,其原子核外有3个电子层、最外层电子数为1,所以Na元素位于第三周期第IA族,故B正确;
C.元素的非金属性越强,其氢化物的还原性越弱,非金属性W>X,所以X的气态氢化物的还原性比W的强,故C错误;
D.元素的非金属性越强,其单质与氢气化合越容易,非金属性Y>W,则Y比W更容易与氢气反应,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断及知识运用能力,明确原子结构、元素周期表结构、元素周期律是解本题关键,注意非金属性与其氢化物稳定性、还原性、其单质氧化性的关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列能构成原电池的一组装置是( )
| A. |  | B. |  | C. |  | D. |  |
13.将NaOH溶液滴入FeCl2溶液中,可观察到的现象是( )
| A. | 生成白色沉淀 | |
| B. | 生成红褐色沉淀 | |
| C. | 有气泡产生 | |
| D. | 先生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀 |
20.下列图示实验或图象错误的是( )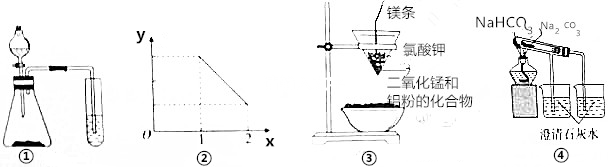

| A. | 用图①装置可比较硫酸、碳酸、硅酸三者的酸性强弱 | |
| B. | 图②表示NO2溶于水完全转化为HNO3时,水(x)与消耗氧气的物质的量(y)之间 关系 | |
| C. | 图③装置可制得金属锰 | |
| D. | 图④装置可验证NaHCO3和NaCO3的热稳定性 |
17.用等体积的0.1mol/L BaCl2溶液,恰好可以使等体积的Fe2(SO4)3、K2SO4和ZnSO4三种溶液中SO42-完全转化为BaSO4沉淀,则三种硫酸盐的物质的量浓度之比为( )
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 1:3:3 |
5.下列说法中错误的是( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必是同系物
④具有同一通式的物质属于同系物.
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必是同系物
④具有同一通式的物质属于同系物.
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有①③④ | D. | ①②③④ |
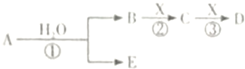 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):