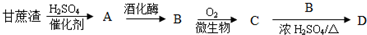题目内容
1.下图表示各物质之间的转化关系.已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色,反应①是工业制氯气的原理.
(1)写出C和M的化学式:CNaOH、MFe(OH)3;写出J的电子式

(2)基于反应①原理的化学工业称为氯碱工业,写出该反应的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑+2NaOH.
(3)写出K和E反应的离子方程式2Fe2++Cl2=2Fe3++2Cl-.写出F溶液和H反应的离子方程式FeO+2H+=Fe2++H2O.
(4)已知:由G分解得到的H、I、J三者的物质的量之比为1:1:1,则G的化学式为FeC2O4.
分析 L放置在空气中生成有颜色的固体M,则M是Fe(OH)3,L是Fe(OH)2;C的焰色反应为黄色,说明C含有钠元素;反应①是工业制氯气的原理,且同时生成气体D与气体E,所以电解的是NaCl溶液,则A和B一种是NaCl,一种是H2O;B是一种常见的无色液体,应为H2O,则A为NaCl,C为NaOH,且D、I是水煤气的主要成分,则D为H2,E为Cl2,I为CO,F为HCl,K为FeCl2,H为FeO<I为CO与水反应生成J与D,则J是CO2,由G分解得到的H、I、J三者的物质的量之比为1:1:1,则G为FeC2O4,据此解答.
解答 解:L放置在空气中生成有颜色的固体M,则M是Fe(OH)3,L是Fe(OH)2;C的焰色反应为黄色,说明C含有钠元素;反应①是工业制氯气的原理,且同时生成气体D与气体E,所以电解的是NaCl溶液,则A和B一种是NaCl,一种是H2O;B是一种常见的无色液体,应为H2O,则A为NaCl,C为NaOH,且D、I是水煤气的主要成分,则D为H2,E为Cl2,I为CO,F为HCl,K为FeCl2,H为FeO<I为CO与水反应生成J与D,则J是CO2,由G分解得到的H、I、J三者的物质的量之比为1:1:1,则G为FeC2O4.
(1)C为NaOH,M为Fe(OH)3,J为CO2,其电子式为: ,
,
故答案为:NaOH;Fe(OH)3; ;
;
(2)基于反应①原理的化学工业称为氯碱工业,该反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑+2NaOH,
故答案为:氯碱工业;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+C12↑+2NaOH;
(3)K和E反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-,
F溶液和H反应的离子方程式:FeO+2H+=Fe2++H2O,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;FeO+2H+=Fe2++H2O;
(4)G的化学式为:FeC2O4,
故答案为:FeC2O4.
点评 本题考查无机物推断,根据物质颜色、状态、物质之间的转化、物质的用途、物质的性质为突破口进行推断,侧重考查分析推断及知识灵活运用能力,题目难度中等.

| A. | 按系统命名法,化合物 的名称为2,4 一二乙基-6-丙基辛烷 的名称为2,4 一二乙基-6-丙基辛烷 | |
| B. | 月桂烯 ( )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液,苯酚钠溶液中出现白色浑浊,说明酸性:醋酸>碳酸>苯酚 | |
| D. | 在盛有试粉溶液的试管中加入70%的硫酸边搅拌边加热5分钟,冷却至室温,再加入氢氧化钠中和至碱性.加入银氨溶液水浴加热,产生银镜.说明淀粉水解能产生还原性糖 |
 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )| A. | Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| C. | 该温度下醋酸的电离平衡常数为10-1 mol•L-1 | |
| D. | 向X点所表示的溶液中加入等体积的0.05 mol•L-1 NaOH溶液:c(H+)=c(CH3COOH)+c(OH-) |
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 上层溶液显橙红色 | 原溶液中有Br- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈紫色 | 原溶液中有K+ |
| D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | NH3→NO→NO2→HNO3 | B. | Al→Al2O3→Al(OH)3→NaAlO2 | ||
| C. | S→SO2→H2SO4→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |