题目内容
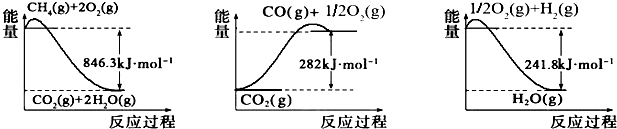
10.研究NOx、SO2、CO等大气污染气体的处理具有重要意义.处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
②S(s)+O2(g)═SO2(g)△H2=-296.0kJ•mol-1
此反应的热化学方程式是2CO(g)+SO2(g)═S(s)+2CO2(g)△H=-270kJ•mol-1.
分析 根据盖斯定律,将所给的反应经加减乘除等变形得所要求的反应,反应热也做相应的变形即可.
解答 解:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=(-283.0KJ•mol-1)×2-(-296.0KJ•mol-1)=-270KJ•mol-1,
热化学反应方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1.
点评 本题依托盖斯定律考查了化学反应与能量变化知识,注意盖斯定律的运用,题目难度中等.

练习册系列答案
相关题目
18.下列有关氧化还原反应的说法中,正确的是( )
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 还原剂在反应中发生还原反应 | |
| C. | 氧化还原反应的本质是电子的转移 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
15.雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧(O3)的监测.下列有关说法正确的是( )
| A. | 臭氧的摩尔质量是48 g | |
| B. | 1mol臭氧的体积是22.4L | |
| C. | 16 g臭氧中含有6.02×1023个氧原子 | |
| D. | 已知每个氧原子内有8个质子,那么1 mol臭氧中含有3mol质子 |
19.某溶液中含有0.3mol NaNO3和0.5mol H2SO4,向该溶液中加入14.4g金属Mg,充分反应后产生NO气体(假定无其他还原产物),NO在标准状况下的体积为( )
| A. | 8.96L | B. | 6.72L | C. | 5.6L | D. | 4.48L |