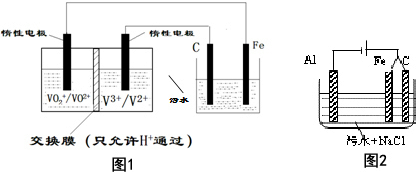
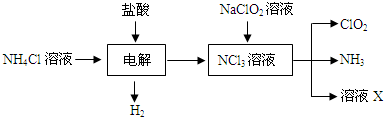
题目内容
16. 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )| A. | Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| C. | 该温度下醋酸的电离平衡常数为10-1 mol•L-1 | |
| D. | 向X点所表示的溶液中加入等体积的0.05 mol•L-1 NaOH溶液:c(H+)=c(CH3COOH)+c(OH-) |
分析 由图象可看出,随pH的增大浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),X点时c(CH3COOH)=c(CH3COO-),结合溶液的电荷守恒、物料守恒解答该题.
解答 解:A、由图得出Y点所表示的溶液中CH3COO-含量高,溶液为酸性,故A正确;
B、溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(CH3COOH)+c(CH3COO-)=0.1 mol•L-1,故有c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1,故B错误;
C、在X点,c(CH3COOH)=c(CH3COO-),电离平衡常数为k=$\frac{[C{H}_{3}CO{O}^{-}]•[{H}^{+}]}{[C{H}_{3}COOH]}$=c(H+)=10-4.75 mol•L-1,故C错误;
D、此时溶液为醋酸钠溶液,质子守恒式为c(OH-)=c(CH3COOH)+c(H+),故D错误;
故选A.
点评 本题属于基本概念与理论的考查,涉及溶液中的电离平衡常数计算、物料守恒和电荷守恒、离子浓度大小比较,溶液中存在水解与电离两个过程的离子浓度大小比较是考试热点内容,学习中要反复加强训练,题目难度中等.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
7.下列说法不正确的是( )
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| D. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
11.下列关于实验的说法正确的是( )
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 燃料电池制作中,为了能吸附更多气体,在两根碳棒表面包上一层薄海绵 | |
| C. | 用硫代硫酸钠溶液和硫酸溶液反应测反应速率是实验中,可以通过判断气泡多少来比较反应速率快慢 | |
| D. | 酸碱中和滴定操作中,用酸润洗过的滴定管需要用蒸馏水再润洗一次 |
6.下列叙述中不正确的是( )
| A. | 铝热反应放出太量的热,因此可以用于冶炼高熔点金属 | |
| B. | 二氧化硅是一种熔沸点很高、硬度很大的氧化物 | |
| C. | 金刚石和石墨的化学性质相似,它们互为同素异形体 | |
| D. | 银白色的镁条在空气中剧烈燃烧后得到淡黄色固体 |