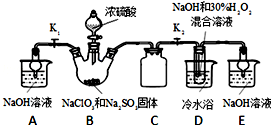
题目内容
19.已知弱电解质在水中的电离平衡常数(25℃)如表:| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
分析 ①弱电解质的电离平衡常数越小,其相应的弱离子水解程度越大,碳酸第二步电离平衡常数小于一水合氨电离平衡常数,则碳酸根离子水解程度大于一水合氨,据此判断碳酸钠溶液酸碱性;
②碳酸根离子水解程度大于铵根离子水解程度,碳酸氢根离子浓度大于一水合氨浓度,溶液中存在电荷守恒和物料守恒,结合电荷守恒和物料守恒判断.
解答 解:①由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),所以(NH4)2CO3溶液呈碱性,故答案为:碱;
②A.根据由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),且c(HCO3-)>c(NH3•H2O),但水解程度较小,所以存在c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3•H2O),故A正确;
B.溶液中存在电荷守恒,c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2 c(CO32-),故B错误;
C.依据溶液中物料守恒,溶液中碳元素守恒得到c (CO32-)+c (HCO3-)+c (H2CO3)=0.1 mol•L-1,故C正确;
D、溶液中存在物料守恒,n(N)=2n(C),c (NH4+)+c (NH3•H2O)=2 c (CO32-)+2c (HCO3-)+2 c (H2CO3),故D正确;
故选:ACD.
点评 本题以盐类水解为载体考查离子浓度大小比较,为高频考点,明确电离平衡常数与弱离子水解程度关系是解本题关键,注意守恒思想的灵活运用,题目难度不大.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2均是非电解质,所以NH3、CO2的水溶液均不能导电 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
7.医生给病人输液,液体里含的糖指的是( )
| A. | 麦芽糖 | B. | 葡萄糖 | C. | 蔗糖 | D. | 淀粉 |
14.有相同质子数的微粒一定是( )
| A. | 同种元素 | B. | 同种分子 | C. | 同种原子 | D. | 不能确定 |
11.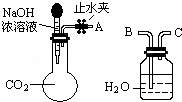 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
(3)在标况下,将4.48L CO2气体通入300mL 1mol/L 的NaOH的稀溶液中,写出该反应的离子方程式(用一个离子方程式表示)2CO2+3OH-=CO32-+HCO3-+H2O.
 纯碱、烧碱等是重要的化工原料.
纯碱、烧碱等是重要的化工原料.(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应.将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是水沿导管由广口瓶进入烧瓶(或:水倒吸进入烧瓶),反应的离子方程式是2OH-+CO2=CO32-+H2O(或CO2+OH-=HCO3-).若其它操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口有气泡产生.
(2)向100mL2mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3g白色固体,该白色固体的组成是NaOH和Na2CO3(写化学式).
设计实验确认该白色固体中存在的阴离子,试完成下列方案.
| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | 产生白色沉淀 | 有CO32- |
| ②过滤,取2mL滤液于试管中 | ||
| ③滴加酚酞 | 溶液变红 | 有OH- |
8.判断下列有关化学基本概念的依据正确的是( )
| A. | 溶液与胶体:不同的本质原因是能否发生丁达尔效应 | |
| B. | 电解质与非电解质:物质本身的导电性 | |
| C. | 氧化还原反应:反应前后元素化合价是否变化 | |
| D. | 纯净物与混合物:是否仅含有一种元素 |
9.同温同压下,等质量的O2 和O3 相比较,下列结论正确的是( )
| A. | 它们的密度之比为 1:1 | B. | 它们的分子数目之比是 1:1 | ||
| C. | 它们的体积之比是 1:1 | D. | 它们的氧原子数目之比为 1:1 |