题目内容
10.亚氯酸钠(NaClO2)是重要的漂白剂,探究小组开展如下实验,回答下列问题: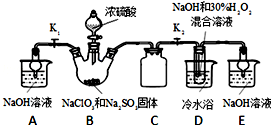
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是防止D瓶溶液倒吸到B瓶中,如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl.
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;装置D中反应生成NaClO2的化学方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2.
(3)反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是SO42-;检验该离子的方法是取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-.
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤.
①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥得到成品.
分析 (1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;
(3)B制得的气体中含有SO2,在装置D中被氧化生成硫酸,可以利用硫酸钡是白色沉淀检验硫酸根;
(4)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制.
解答 解:(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:防止D瓶溶液倒吸到B瓶中;NaClO3和NaCl;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,反应的方程式为2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)B制得的气体中含有SO2,在装置D中被氧化生成硫酸,溶液中可能存在SO42-,用氯化钡溶液检验SO42-,具体操作:取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-,
故答案为:SO42-;取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;
(4)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;低于60℃干燥.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,题目难度中等.

| A. | 氯乙烷与氢氧化钠醇溶液共热:C2H5Cl+OH-$\stackrel{△}{→}$C2H5OH+Cl- | |
| B. | 溴乙酸与热氢氧化钠溶液反应:BrCH2COOH+OH-=BrCH2COO-+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | 乙醛与氢氧化铜碱性悬浊液共热: CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
| A. | HR溶液和KCl溶液不发生反应 | |
| B. | 能与水以任意比例互溶 | |
| C. | 0.1 mol•L-1 的HR溶液中c(R- )=0.01 mol•L-1 | |
| D. | HR属于共价化合物 |
| A. | 简单离子半径:W>Y>Z | |
| B. | X、Y与Z形成的化合物中既有极性共价键又有离子键 | |
| C. | Z与Y形成的化合物为一种高温结构陶瓷 | |
| D. | X与Y只能形成10电子分子,不能形成18电子分子 |
| A. | 用托盘天平称取 5.72 gNaCl晶体 | |
| B. | 用酸式滴定管量取20.00 mL的酸性KMnO4溶液 | |
| C. | 用pH试纸测氯水的pH=2.2 | |
| D. | 用带磨口玻璃塞的试剂瓶保存NaOH溶液 |
①脱水性 ②吸水性③强氧化性 ④强酸性 ⑤高沸点.
| A. | 只有①③⑤ | B. | 只有②③④ | C. | 只有③④⑤ | D. | ①②③④⑤均有 |
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①你认为该溶液呈碱性(填“酸”“中”“碱”).
②就该溶液中粒子之间有下列关系式,你认为其中正确的是ACD
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)