题目内容
12.下列离子方程式书写正确的是( )| A. | 硫酸铝中加入过量的氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝与盐酸反应:2Al(OH)3+6H+═2Al3++6H20 | |
| C. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 偏铝酸钠溶液与适量稀硝酸反应:AlO2-+H++H20═Al(OH)3↓ |
分析 A.弱电解质写化学式,且氢氧化铝难溶于弱碱;
B.氢氧化铝能溶于强酸溶液生成铝盐和水,其计量数之比要最简;
C.硫酸铜和氢氧化钡反应生成硫酸钡和氢氧化铜两种沉淀;
D.偏铝酸钠和适量稀硝酸反应生成氢氧化铝和水.
解答 解:A.弱电解质写化学式,且氢氧化铝难溶于弱碱,离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A错误;
B.氢氧化铝能溶于强酸溶液生成铝盐和水,其计量数之比要最简,所以离子方程式为:Al(OH)3+3H+═Al3++3H20,故B错误;
C.硫酸铜和氢氧化钡反应生成硫酸钡和氢氧化铜两种沉淀,离子方程式为Ba2++SO42-+Cu2++2OH-═BaSO4↓+Cu(OH)2↓,故C错误;
D.偏铝酸钠和适量稀硝酸反应生成氢氧化铝和水,离子方程式为AlO2-+H++H2O=Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高频考点,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等,易错选项是C,注意:易漏掉部分离子方程式.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
2.下列说法正确的是( )
| A. | 气体的摩尔体积约为22.4L•mol-1 | |
| B. | 在标准状况下,1mol任何物质所占的体积都约为22.4L | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等,都是98g/mol |
3.氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列有关说法正确的是( )
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列有关说法正确的是( )
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?F-(aq)+H+(aq)△H=+10.4 kJ•mol-1 | |
| B. | NaF水解时的热化学方程式为F-(aq)+H2O(aq)=HF(aq)+OH-(aq)△H=+67.7KJ•mol | |
| C. | 溶液温度升高后,一定能促进弱电解质的电离 | |
| D. | 将含有0.1molHF与0.1molNaOH的两种物质混合后放出的热量为6.77KJ |
20.下列说法正确的是( )
| A. | 铁是一种非常活泼的金属 | B. | 镁可以与氧气反应生成氧化镁 | ||
| C. | 钠的硬度大 | D. | 铝的常见氧化物是Al3O4 |
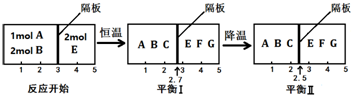
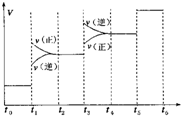 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.