题目内容
10.AgCl(s)?Ag+(aq)+Cl-(aq),平衡时,Ksp=c(Ag+)•c(Cl-),过量氯化银分别投入:①100mL水
②24mL 0.1mol•L-1 NaCl
③10mL 0.1mol•L-1 MgCl2
④30mL 0.1mol•L-1 AgNO3溶液中,各溶液中c(Ag+)由大到小的顺序为( )
| A. | ③①②④ | B. | ④③②① | C. | ①②③④ | D. | ④①②③ |
分析 温度不变时Ksp=C(Ag+)•C(Cl-)为定值,Cl-浓度越大,则Ag+的浓度越小,结合溶解平衡常数来解答.
解答 解:先根据加入c(Cl-)大小比较,加入c(Cl-)越小,则c(Ag+)越大,①100mL蒸馏水中,c(Cl-)=0,②24mL 0.1mol•L-1NaCl,c(Cl-)=0.1mol•L-1,③10mL 0.1mol•L-1MgCl2 中,c(Cl-)=0.2mol•L-1,则Cl-浓度:③>②>①,由Ksp=C(Ag+)•C(Cl-)为定值,可知c(Ag+)由大到小的顺序是:①②③,
而④加入的是银离子,所以30mL 0.1mol•L-1AgNO3溶液中c(Ag+)=0.1mol•L-1,所以④中c(Ag+)最大,
综上所述,c(Ag+)由大到小的顺序是:④①②③,
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp只与温度有关及离子浓度的比较方法为解答的关键,侧重分析与应用能力的考查,注意溶解平衡移动的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.向20mL1mol/LAl2(SO4)3溶液中,加入30mLKOH溶液,充分反应后,得0.78g沉淀,则KOH溶液的物质的量浓度为( )
| A. | 5mol/L | B. | 3mol/L | C. | 2mol/L | D. | 7mol/L |
1.下列有关化学用语使用正确的是( )
| A. | 符号为${\;}_8^{18}O$的原子常用于文物年代的测定 | |
| B. | CO2分子比例模型: | |
| C. | H2O2的电子式: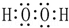 | |
| D. | 结构简式为CH2CH2的分子可发生加成反应 |
15.下列说法中错误的是( )
| A. | 乙烷和乙烯的熔点都比CH4的高 | B. | 乙烷和乙烯都可发生加成反应 | ||
| C. | 乙烷能发生氧化反应 | D. | 苯和乙烯都是常见化工原料 |
2.一定温度下,将2mol SO2 和1mol O2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
| A. | 反应放出197 kJ 的热量 | |
| B. | 生成SO3为2 mol | |
| C. | SO2和SO3物质的量之和为2 mol | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
19.有六种微粒分别是1940X、2040Y、1840Z、1940Q+、2040K2+、2040M,它们所属元素的种类为( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
20.A、B、C、D为短周期元素,请根据下表信息回答问题.
(1)B在元素周期表的位置:第二周期VA族;B气态氢化物的电子式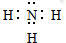
(2)C的最高价氧化物分别与强酸、强碱反应的离子方程式为Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O;
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质的化学方程式为Cl2+H2O=HCl+HClO.
| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
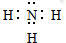
(2)C的最高价氧化物分别与强酸、强碱反应的离子方程式为Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O;
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质的化学方程式为Cl2+H2O=HCl+HClO.
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍.
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:若Z元素原子的最外层电子数是电子层数的2倍. .
.