题目内容
20.A、B、C、D为短周期元素,请根据下表信息回答问题.| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
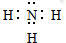
(2)C的最高价氧化物分别与强酸、强碱反应的离子方程式为Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O;
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质的化学方程式为Cl2+H2O=HCl+HClO.
分析 A、B、C、D为短周期元素,工业上通过分离液态空气获得A的单质,且其单质能助燃,则A为O元素;B的气态氢化物显碱性,则B为N元素;C形成+3价阳离子的核外电子排布与氖原子相同,则C为Al;D在第三周期中原子半径最小,则D为Cl,据此进行解答.
解答 解:A、B、C、D为短周期元素,工业上通过分离液态空气获得A的单质,且其单质能助燃,则A为O元素;B的气态氢化物显碱性,则B为N元素;C形成+3价阳离子的核外电子排布与氖原子相同,则C为Al;D在第三周期中原子半径最小,则D为Cl,
(1)B为N元素,原子序数为7,位于周期表中第二周期VA族;气态氢化物为氨气,氨气为共价化合物,其电子式为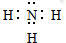 ,
,
故答案为:第二周期VA族;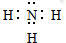 ;
;
(2)C为Al元素,其最高价氧化物为氧化铝,氧化铝为两性氧化物,与强酸、强碱溶液反应的离子方程式分别为:Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;Al2O3+2OH-=2AlO2-+H2O;
(3)D的单质为氯气,A为O元素,其氢化物为水,氯气与水反应生成具有漂白性的次氯酸,反应的化学方程式为:Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO.
点评 本题考查结构性质位置关系应用,题目难度不大,侧重对物质性质及化学用语的考查,推断元素为解答结构,答题时注意化学用语的规范表达,注意掌握原子结构与元素周期律、元素周期表的关系.

练习册系列答案
相关题目
10.AgCl(s)?Ag+(aq)+Cl-(aq),平衡时,Ksp=c(Ag+)•c(Cl-),过量氯化银分别投入:
①100mL水
②24mL 0.1mol•L-1 NaCl
③10mL 0.1mol•L-1 MgCl2
④30mL 0.1mol•L-1 AgNO3溶液中,各溶液中c(Ag+)由大到小的顺序为( )
①100mL水
②24mL 0.1mol•L-1 NaCl
③10mL 0.1mol•L-1 MgCl2
④30mL 0.1mol•L-1 AgNO3溶液中,各溶液中c(Ag+)由大到小的顺序为( )
| A. | ③①②④ | B. | ④③②① | C. | ①②③④ | D. | ④①②③ |
11.通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能,键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的(△H)等于反应物的总键能与生成物的总键能之差.
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) $\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热AH为( )
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| l键能/kJ•mol | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | +412 kJ•mol-1 | B. | -412 kJ•mol-1 | C. | +236 kJ•mol-1 | D. | -236 kJ•mol-1 |
8.下列关叙述正确的是( )
| A. | 橡胶一定属于合成材料 | |
| B. | 豆油、花生油、牛油都属于酯类 | |
| C. | 区别植物油、矿物油可以加水后振荡,观察其是否分层 | |
| D. | 1 mol乙醇与足量的钠反应可以生成3 mol的氢气 |
5.下列有关分子结构与性质的叙述中正确的是( )
| A. | CS2、H2O、C2H2都是直线形分子 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | CH2=CH2和CH≡CH分子中含有的π键个数相等 | |
| D. | CH4、CCl4、SiH4都是含有极性键的非极性分子 |
10.有机物 的一氯代物有(不考虑立体异构)( )
的一氯代物有(不考虑立体异构)( )
 的一氯代物有(不考虑立体异构)( )
的一氯代物有(不考虑立体异构)( )| A. | 5种 | B. | 7种 | C. | 9种 | D. | 11种 |

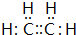 ;C的分子式:C2H4O;D中的官能团:羧基.
;C的分子式:C2H4O;D中的官能团:羧基. .
.