题目内容
20.向20mL1mol/LAl2(SO4)3溶液中,加入30mLKOH溶液,充分反应后,得0.78g沉淀,则KOH溶液的物质的量浓度为( )| A. | 5mol/L | B. | 3mol/L | C. | 2mol/L | D. | 7mol/L |
分析 根据Al2(SO4)3溶液与KOH溶液的反应计算分析,20mL1mol/LAl2(SO4)3全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.
解答 解:20mL1mol/Al2(SO4)3完全转化为沉淀的质量为0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,
二是使Al(OH)3部分溶解,
设KOH的浓度为c,当KOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
c=1mol/L,
当KOH使Al(OH)3部分溶解时,设KOH的物质的量为x,根据反应:
Al3++3OH-=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3+OH-=AlO2-+H2O
78g 1mol
(3.12-0.78)g (x-0.12mol)
x=0.15mol,
则KOH的物质的量浓度为:c=$\frac{0.15mol}{0.03L}$=5mol/L,
由上述分析计算可知,KOH溶液的物质的量浓度为1mol/L或5mol/L,故选A.
点评 本题考查物质的量浓度的计算,题目难度中等,注意判断氯化铝反应的程度,为解答本题的关键,用讨论法解答.

练习册系列答案
相关题目
18.1mol下列有机物中与足量的NaHCO3溶液反应.可得2molCO2的是( )
| A. |  | B. | HOCH2CH2OH | C. | HOOC-COOH | D. | CH3COOH |
8.下列物质在常温下发生水解时,对应的离子方程式正确的是( )
| A. | Na2CO3溶液:CO32-+2H2O?H2CO3+2OH- | |
| B. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ | |
| C. | CuSO4溶液:Cu2++2H2O?Cu(OH)2↓+2H+ | |
| D. | NaClO溶液:ClO-+H2O═HClO+OH- |
15.钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性.广泛应用于钢铁、航空航天、能源、化工等领域.中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料--赤泥中提取金属钒,具体工艺流程图如下:
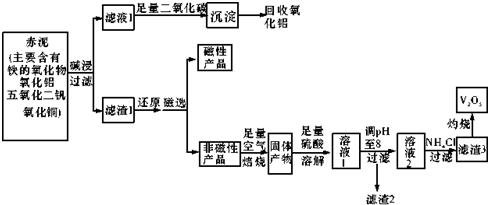
已知:I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以V02+和V03-的形式存在,存在平衡V02++H20?V03-+2H+.
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
Ⅲ.部分离子的沉淀pH值:
请回答下列问题:
(1)碱浸步骤中最好选用a.
a.Na0H溶液b.氨水 c.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3+HCO3-;.
(3)磁选步骤得到的磁性产品为铁.
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使使VO2+转化为VO3-.
(5)滤渣3的主要成分为NH4VO3,工业上常用铝热反应法由V205冶炼金属钒,请写出反应的化学方程式3V205+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al203.

已知:I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以V02+和V03-的形式存在,存在平衡V02++H20?V03-+2H+.
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
| 物质 | V205 | NH4V03 | (V02)2S04 |
| 溶解性 | 难溶 | 难溶 | 易溶 |
| Cu2+ | Fe2+ | Fe3+ | |
| 开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
| 完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
(1)碱浸步骤中最好选用a.
a.Na0H溶液b.氨水 c.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3+HCO3-;.
(3)磁选步骤得到的磁性产品为铁.
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使使VO2+转化为VO3-.
(5)滤渣3的主要成分为NH4VO3,工业上常用铝热反应法由V205冶炼金属钒,请写出反应的化学方程式3V205+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al203.


 ;Ⅰ中发生反应的还原剂是Na2SO3(填化学式).
;Ⅰ中发生反应的还原剂是Na2SO3(填化学式).