题目内容
1.在下列条件下,两种气体的分子数一定相等的是( )| A. | 同温度,同体积的N2和O2 | B. | 同质量,不同密度的N2和CO | ||
| C. | 同压强,同体积的H2和CH4? | D. | 同体积,同密度的CO2和N2 |
分析 两种气体的分子数一定相等,由N=nNA可知,气体的物质的量相同,结合m=nM、m=ρV,V=nVm计算.
解答 解:A.同温度,同体积时,压强未知,不能确定气体的物质的量关系,故A不选;
B.N2和CO的摩尔质量均为28g/mol,同质量时物质的量相同,则分子数相同,故B选;
C.同压强,同体积时,温度未知,不能确定气体的物质的量关系,故C不选;
D.同体积,同密度时,由m=ρV可知,质量相同,但CO2和N2的摩尔质量分别为44g/mol、28g/mol,物质的量不同,气体分子数不同,故D不选;
故选B.
点评 本题考查阿伏伽德罗定律及计算,为高频考点,把握物质的量与质量、体积的关系为解答的关键,侧重分析与计算能力的考查,注意气体的体积与温度、压强均有关,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
11.如图所示,2个X分子反应生成一个Y分子和3个Z分子,下列判断不正确的( )
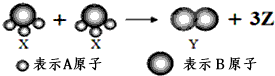

| A. | 该反应属于分解反应 | |
| B. | 该反应属于氧化还原反应 | |
| C. | X、Y、Z三种物质均属于非电解质 | |
| D. | 根据质量守恒定律可推知,1个Z分子含有两个A原子 |
12.以下实验或操作不能达到目的是( )
| A. | 用分液漏斗除去苯中的少量苯酚 | |
| B. | 用氨水鉴别Mg2+和Ag+ | |
| C. | 用水鉴别苯、乙醇、四氯化碳 | |
| D. | 用激光笔检验淀粉溶液和葡萄糖溶液 |
9.下列离子方程式错误的是( )
| A. | 氧化铁与稀硫酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 小苏打溶液中加入过量石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 硫酸与氯化钡反应:SO42-+Ba2+═BaSO4↓ | |
| D. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
16.下列有关炼铁和炼钢的说法中,错误的是( )
| A. | 炼铁目的是将生铁进行还原 | B. | 炼铁时加入石灰石除脉石 | ||
| C. | 炼钢目的是将生铁进行氧化 | D. | 炼钢时加入生石灰造渣 |
13.下列化学用语表达错误的是( )
| A. | NH3的电子式: | B. | Al2O3+3H2 $\stackrel{高温}{→}$ 2Al+3H2O | ||
| C. | 氯离子的结构示意图: | D. | N原子的轨道表示式: |
10.下列溶液中微粒浓度关系一定正确的是( )
| A. | pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 | |
| B. | 氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] | |
| C. | pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 | |
| D. | 0.10 mol•L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
11.下列物质的水溶液因水解而呈碱性的是( )
| A. | NaOH | B. | (NH4)2SO4 | C. | Na2O | D. | CH3COONa |



