题目内容
11.下列物质的水溶液因水解而呈碱性的是( )| A. | NaOH | B. | (NH4)2SO4 | C. | Na2O | D. | CH3COONa |
分析 强碱弱酸盐的水溶液中,弱酸根离子水解使溶液显碱性,以此来解答.
解答 解:A.NaOH为强碱,电离使溶液显碱性,故A不选;
B.(NH4)2SO4为强酸弱碱盐,水解显酸性,故B不选;
C.Na2O与水反应生成NaOH,电离使溶液显碱性,故C不选;
D.CH3COONa为强碱弱酸盐,弱酸根离子水解使溶液显碱性,故D选;
故选D.
点评 本题考查盐类水解,为高频考点,把握盐的类别、水解规律为解答的关键,侧重分析与应用能力的考查,注意电离与水解的判断,题目难度不大.

练习册系列答案
相关题目
1.在下列条件下,两种气体的分子数一定相等的是( )
| A. | 同温度,同体积的N2和O2 | B. | 同质量,不同密度的N2和CO | ||
| C. | 同压强,同体积的H2和CH4? | D. | 同体积,同密度的CO2和N2 |
2.下列有机物的结构简式和名称都正确的是( )
| A. | 2-甲基丁醛 CH3CH2 (CH3)CHCOH | B. | 硬酯酸甘油脂 | ||
| C. | TNT | D. | α-氨基丙酸 CH3CH(NH2)COOH |
19.铁铝矾[Al2Fe(SO4)4•xH2O]有净水作用,将其溶于水中得到浅绿色溶液,有关该溶液的叙述正确的是( )
| A. | 该溶液显中性 | |
| B. | 该溶液中:2 c(Al3+)+c(Fe2+)+c(H+ )=4 c(SO42-)+c(OH-) | |
| C. | 在空气中蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 | |
| D. | 向该溶液中加入Ba(OH)2溶液,当SO42-完全沉淀时,Al3+、Fe2+恰好被完全沉淀 |
6.聚乙炔能够导电,下列关于聚乙炔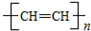 和聚合物A
和聚合物A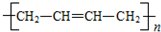 的说法中正确的是( )
的说法中正确的是( )
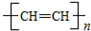 和聚合物A
和聚合物A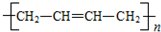 的说法中正确的是( )
的说法中正确的是( )| A. | 两种聚合物的单体互为同系物 | |
| B. | 聚合物A不属于单双键交错的结构. | |
| C. | 聚合物A的相对分子质量是聚乙炔的两倍 | |
| D. | 两种聚合物的单体各1 mol,分别与Br2发生加成反应时最多消耗Br2的物质的量之比为2:1 |
16.下列说法正确的是( )
| A. | 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度 | |
| B. | 在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05mol•L-1下降到0.03 mol•L-1,该双氧水在这2h中分解的平均反应速率约为0.015 mol•L-1•h-1 | |
| C. | 其它条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢 | |
| D. | 一定条件下,固定体积的容器中发生反应A(g)+B(g)?2C(g),当容器内A、B、C的浓度之比为1:1:2时,该反应一定处于平衡状态 |
3.下列物质的水溶液因水解呈酸性的是( )
| A. | FeCl3 | B. | Na2CO3 | C. | CH3COOH | D. | KHSO4 |
2.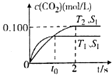 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
(1)该反应为放热(填“放热”或“吸热”)反应,在T2温度下,0~2s内的平均反应速率v(N2)=0.05mol/(L•s).
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,请画出在T1、S2条件下反应达到平衡过程中c(CO2)的变化曲线.
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
①T3时该反应的平衡常数K=0.5,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2,0.5molN2,则反应向逆(填“正”或“逆”)反应方向进行.
②平衡时两容器中CO的转化率:Ⅰ<Ⅱ(填“>”、“<”或“=”);容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为增加NO量或较低温度或增大压强(答一条即可).
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)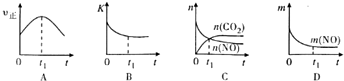
(5)有人设想按反应:2CO(g)=2C(s)+O2(g)来除去尾气中的CO,简述该设想能否实现△H>0、△S<0,则在任何温度下△G>0,不可能自发进行.
 汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:
汽车尾气净化的主要原理为2NO(g)+2CO(g)$\stackrel{催化剂}{→}$2CO2+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示.据此判断:(1)该反应为放热(填“放热”或“吸热”)反应,在T2温度下,0~2s内的平均反应速率v(N2)=0.05mol/(L•s).
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,请画出在T1、S2条件下反应达到平衡过程中c(CO2)的变化曲线.
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
| 容器编号 | 起始物质的量 | 平衡时物质的量 |
| Ⅰ | 2.0mol NO,2.0mol CO | 1.0mol CO2 |
| Ⅱ | 4.0mol NO,4.0mol CO |
②平衡时两容器中CO的转化率:Ⅰ<Ⅱ(填“>”、“<”或“=”);容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为增加NO量或较低温度或增大压强(答一条即可).
(4)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)

(5)有人设想按反应:2CO(g)=2C(s)+O2(g)来除去尾气中的CO,简述该设想能否实现△H>0、△S<0,则在任何温度下△G>0,不可能自发进行.
3.下列化学用语的书写正确的是( )
| A. | 氮气的电子式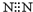 | B. | 乙烯的结构式:C2H4 | ||
| C. | 用电子式表示HCl的形成过程: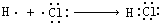 | D. | 乙醇的分子式:C2H5OH |