题目内容
6.在一真空容器中,充入10mol N2,30mol H2,发生反应N2(g)+3H2(g)?2NH3(g),在一定条件下达到平衡时,N2的转化率为25%.若在同一容器中,在相同温度下,向容器中充入NH3,欲使达到平衡时各成分的质量分数与上述平衡相同,则起始时NH3的量和达到平衡时NH3的转化率为( )| A. | 20 mol、25% | B. | 20 mol、75% | C. | 40 mol、30% | D. | 10mol、50% |
分析 恒温恒容下,若开始只充入NH3,欲达到平衡时的各成份的百分含量与原平衡时相同,二者为等效平衡,由于反应前后气体的化学计量数之和不相等,故平衡时对应组分的物质的量相等,根据极限法计算氨气的物质的量,根据方程式计算原平衡时氨气的物质的量,进而计算开始只充入NH3时氨气的转化率.
解答 解:恒温恒容下,若开始只充入NH3,欲达到平衡时的各成份的百分含量与原平衡时相同,二者为等效平衡,由于反应前后气体的化学计量数之和不相等,故平衡时对应组分的物质的量相等,需要氨气的物质的量=10mol×2=20mol,原平衡中参加反应氮气为10mol×25%=2.5mol,由方程式可知平衡时氨气的物质的量=2.5mol×2=5mol,故若开始只充入NH3,氨气的转化率=$\frac{20mol-5mol}{20mol}$×100%=75%,
故选B.
点评 本题考查化学平衡计算、等效平衡,理解等效平衡规律是解题关键,注意不同方向建立等效平衡,转化率之和为1,难度中等.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
3.下列有关实验的描述,错误的是( )
| A. | 水和四氯化碳可以用分液漏斗进行分离 | |
| B. | 提取溴水中的溴单质,可以用四氯化碳进行萃取 | |
| C. | 可以用高温加热的方法除去CaO中混有的CaCO3 | |
| D. | 可以用蒸发结晶的方法除去KNO3固体中混有的少量NaCl |
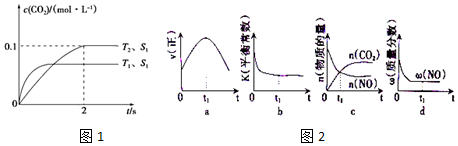
17. 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )
 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )| A. | p3>p4,y轴表示A的物质的量 | |
| B. | p3<p4,y轴表示B的体积分数 | |
| C. | p3<p4,y轴表示混合气体的密度 | |
| D. | p3>p4,y轴表示混合气体的平均相对分子质量 |
11.下列关于金属Na的叙述中,说法不正确的是( )
| A. | Na在空气中燃烧,发出黄色火焰 | B. | Na在空气中燃烧,产物是Na2O | ||
| C. | Na是银白色金属,硬度小,熔点低 | D. | Na、K合金可作原子反应堆的导热剂 |
15.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示.下列说法错误的是( )
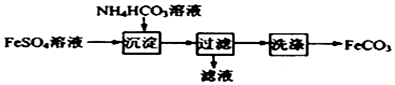

| A. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| B. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| C. | 沉淀过程中有CO2气体放出 | |
| D. | 检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液 |
 有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15.
有可逆反应:Fe(s)+CO2(g)?FeO(s)+CO(g).已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15. 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化: