题目内容
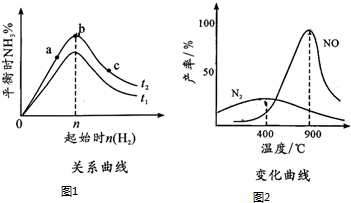
17. 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )| A. | p3>p4,y轴表示A的物质的量 | |
| B. | p3<p4,y轴表示B的体积分数 | |
| C. | p3<p4,y轴表示混合气体的密度 | |
| D. | p3>p4,y轴表示混合气体的平均相对分子质量 |
分析 由图(Ⅰ)中a、b的相对位置知,增压(因p2>p1),C%升高,故x=1;由b、c的相对位置知,升温(因为T1>T2),C%降低.故正反应为放热反应.
即该反应为:A(g)+B(g)?C(g)(正反应为放热反应),由反应式可知,升温和降压均可使反应向逆反应方向移动.
由图Ⅱ,y随温度的升高而降低,可判断y为A的转化率或混合气体的平均摩尔质量等量,结合压强对平衡移动的影响判断P3、P4的关系.
解答 解:图象中先出现拐点,为先达到平衡,依据图(Ⅰ)中a、b的相对位置知,增压(因同温度下,压强大的先到达平衡,所以p2>p1),w(C)升高,故x=1;由b、c的相对位置知,升温(因为同压强下,温度高的先到达平衡,所以T1>T2),w(C)降低,故正反应为放热反应.即该反应为:A(g)+B(g)?C(g)(正反应为放热反应),由反应式可知,升温和降压均可使反应向逆反应方向移动,由图(Ⅱ)知:因随着温度升高y降低,故y降低的方向必为压强减小的方向,所以,P3>P4,故BC错误;
随着温度的升高,平衡将向左移动,B的转化率降低;随着压强的减小,B物质的转化率减小,所以B的体积分数增大;平衡逆移气体总物质的量增大,所以气体的平均摩尔质量减小,所以D符合.
故选D.
点评 本题旨在考查学生对化学平衡图象的理解.解答这类图象题,首先要“译”出其化学含义.由于勒夏特列原理只适用于“单因素”(浓度或温度或压强)改变,分析时应固定一个物理量,分析另一物理量对纵坐标的影响,题目难度中等.

练习册系列答案
相关题目
14.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 常温常压下,48 g O3中的氧原子数为3NA | |
| B. | 24 g金属镁变为镁离子时失去的电子数为NA | |
| C. | 4℃时9 mL水和标准状况下11.2 L氮气中的原子数均为NA | |
| D. | 2 mol•L-l的CuCl2溶液中含有的氯离子数为4NA |
8.某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)实验步骤如下:
①往100mL 0.1mol•L-1的CaCl2溶液中加入100mL 0.1mol•L-1的Na2SO4溶液,立即有白色沉淀生成.
②向上述悬浊液中加入足量Na2CO3固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④_______.
(1)步骤①所得悬浊液中c(Ca2+)=0.003 mol•L-1
(2)写出第②步发生反应的离子方程式:CO32-(aq)+CaSO4(s)=SO42-(aq)+CaCO3(s).
(3)请补充第④步操作及发生的现象加入盐酸,沉淀完全溶解,有气泡冒出.
(4)请写出该原理在实际生产生活中的一个应用用于除去锅垢:
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp | 2.8×10-9 | 9×10-6 |
②向上述悬浊液中加入足量Na2CO3固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④_______.
(1)步骤①所得悬浊液中c(Ca2+)=0.003 mol•L-1
(2)写出第②步发生反应的离子方程式:CO32-(aq)+CaSO4(s)=SO42-(aq)+CaCO3(s).
(3)请补充第④步操作及发生的现象加入盐酸,沉淀完全溶解,有气泡冒出.
(4)请写出该原理在实际生产生活中的一个应用用于除去锅垢:
5.在固定容积的密闭容器中,放入amolX,发生反应:2X?Y(g)+Z(s),并达到平衡状态,此时升高温度,气体的密度增大.下列叙述正确的是( )
| A. | 平衡后移走部分Z,平衡正向移动 | |
| B. | 若正反应为放热反应,则X一定为气态 | |
| C. | 若X为非气态,则正反应为放热反应 | |
| D. | 若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大 |
12.光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)制备.图1为此反应的反应速率随温度变化的曲线,如图2为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线.下列说法不正确的是( )


| A. | 0~6 min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1 | |
| B. | 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动 | |
| C. | 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)>T(15) | |
| D. | 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同 |
6.在一真空容器中,充入10mol N2,30mol H2,发生反应N2(g)+3H2(g)?2NH3(g),在一定条件下达到平衡时,N2的转化率为25%.若在同一容器中,在相同温度下,向容器中充入NH3,欲使达到平衡时各成分的质量分数与上述平衡相同,则起始时NH3的量和达到平衡时NH3的转化率为( )
| A. | 20 mol、25% | B. | 20 mol、75% | C. | 40 mol、30% | D. | 10mol、50% |
7.下列有关实验操作和实验事故处理不正确的是( )
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |