题目内容
14. 乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图:
乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图:回答下列问题:
(1)M的分子式是C4H8O2
(2)W的结构简式为CH2ClCH2OH
(3)反应X→Y的反应类型是加成反应
(4)写出反应E→F的化学方程式:nCH2=CHCl$\stackrel{一定条件}{→}$
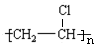
(5)上述框图中,能与酸性高锰酸钾溶液反应的烃的衍生物是Y、W、Z(填字母)
分析 X为CH2=CH2,与水反应生成的Y为CH3CH2OH,Z为CH3COOH,由转化关系可知M为CH3COOCH2CH3,W为CH2ClCH2OH,E为CH2=CHCl,发生加聚反应生成F为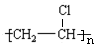 ,以此解答该题.
,以此解答该题.
解答 解:(1)M为CH3COOCH2CH3,分子式为C4H8O2,故答案为:C4H8O2;
(2)由以上分析可知W为CH2ClCH2OH,故答案为:CH2ClCH2OH;
(3)乙烯与水发生加成反应生成乙醇,故答案为:加成反应;
(4)F为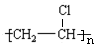 ,反应的方程式为nCH2=CHCl$\stackrel{一定条件}{→}$
,反应的方程式为nCH2=CHCl$\stackrel{一定条件}{→}$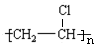 ,故答案为:nCH2=CHCl$\stackrel{一定条件}{→}$
,故答案为:nCH2=CHCl$\stackrel{一定条件}{→}$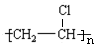 ;
;
(5)题中涉及有机物能与高锰酸钾发生反应的有机物应含有碳碳双键或羟基,可为CH3CH2OH、CH2ClCH2OH、CH2=CHCl、故答案为:Y、W、Z.
点评 本题以乙烯为原料合成聚氯乙烯和二乙酸乙酯为线路,为高考常见题型,考查反应类型、命名、有机物推断、有机反应方程式书写等,涉及烯烃、醇、羧酸等性质,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,难度中等.

练习册系列答案
相关题目
4.最近我国“人造太阳”研究获重大进展.核聚变中下列质子数小于中子数的原子是( )
| A. | ${\;}_{1}^{2}$H | B. | ${\;}_{1}^{3}$H | C. | ${\;}_{2}^{4}$He | D. | ${\;}_{1}^{1}$H |
5.X、Y、Z、M、W五种主族元素分属三个短周期,且原子序数依次增大.X、Z同族,可形成离子化合物ZX;Y′、M同主族,可形成MY2、MY3两种分子.下列说法中正确的是( )
| A. | 原子半径的大小:W>Z>X | |
| B. | 气态氢化物的还原性:Y>M | |
| C. | 最高价氧化物的水化物的酸性:M>W | |
| D. | X与Y可形成10电子分子和18电子分子 |
2.短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,Y原子最外层电子数是其内层电子总数的3倍,W原子的核电荷数等于X、Z原子的核电荷数之和,X和Z同主族.下列说法正确的是( )
| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | Z的最高价氧化物对应水化物的碱性比W的强 | |
| C. | 化合物X2Y2和Z2Y2所含化学键类型完全相同 | |
| D. | 工业上常用电解熔融W的氧化物制备W的单质 |
9.下列说法正确的是( )
| A. | 工业电解精炼铜时,粗铜与外电源的正极相连 | |
| B. | 常温下向纯水中加入盐酸,水的离子积减小 | |
| C. | 催化剂既能改变化学反应速率,也能改变焓变 | |
| D. | 其它条件不变时,升髙温度,吸热反应的v(正)增大,v(逆)减小 |
5.下列反应的离子方程式正确的是( )
| A. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 氧化镁与稀硫酸:MgO+2H+═Mg2++H2O | |
| D. | 常温下,将铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
12.在电解水制取H2和O2时,为了增强导电性,常常在水中加入一些电解质,下列物质可选用( )
| A. | NaCl | B. | CuCl2 | C. | NaOH | D. | CuSO4 |
9.随着碳原子数的增多,碳元素的质量分数也增大的是( )
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 苯的同系物 |
10.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | 配合物中中心原子的电荷数和配位数均为6 | |
| B. | Pt4+提供孤对电子 | |
| C. | Cl-和NH3分子均与Pt4+配位 | |
| D. | 配合物中Cl-与Pt4+配位,而NH3分子不配位 |