题目内容
19.把48.8克铁粉和氧化铁粉末的混合物,溶于2升稀盐酸中,恰好完全反应,在标准状况下收集到氢气2.24升,且在反应后的溶液中不存在Fe3+,求:(1)原混合物中铁和氧化铁各为多少克?
(2)原盐酸溶液的物质的量浓度是多少?
分析 (1)设出铁粉、氧化铁的物质的量,然后分别根据质量、电子守恒列式计算出二者的物质的量,最高价m=nM计算出铁粉、氧化铁的质量;
(2)盐酸恰好反应,则反应中恰好生成氯化亚铁,根据质量守恒定律计算出HCl的物质的量,最高价c=$\frac{n}{V}$计算出原盐酸的物质的量浓度.
解答 解:(1)设48.8克混合物中含有Fe和Fe2O3的物质的量分别为x、y,
标准状况下2.24L氢气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,在反应后的溶液中不存在Fe3+,说明反应后铁元素完全转化成Fe2+,
根据总质量可得:①56x+160y=48.8,
根据电子守恒可得:②2x=2y+0.1mol×2,
联立①②解得:$\left\{\begin{array}{l}{x=0.3mol}\\{y=0.2mol}\end{array}\right.$,
则混合物中含有Fe的质量为:56g/mol×0.3mol=16.8g,含有氧化铁的质量为:160g/mol×0.2mol=32g,
答:原混合物中铁的质量为16.8g,氧化铁的质量为32g;
(2)稀盐酸恰好反应,且反应后溶液中不存在Fe3+,则HCl恰好反应生成氯化亚铁,根据质量守恒可知:n(HCl)=2n(FeCl2)=2(0.3mol+0.2mol×2)=1.4mol,
所以原盐酸的物质的量浓度为:c(HCl)=$\frac{1.4mol}{2L}$=0.7mol/L,
答:原盐酸的物质的量浓度为0.7mol/L.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
9.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A. | NaClO(aq)中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| B. | FeCl2在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH- | |
| C. | AlCl3(aq)中投入少量Na:Al3++4Na+2H2O=AlO2-+4Na++2H2↑ | |
| D. | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
14.下列化学现象的描述,错误的是( )
| A. | 氢氧化钠固体溶于水放热 | |
| B. | 红磷在空气中燃烧,产生大量白雾 | |
| C. | 分别蘸有浓盐酸与浓氨水的玻璃棒靠近产生白烟 | |
| D. | 细铁丝在氧气中燃烧,火星四射,生成黑色固体 |
8.浓度均为0.1mol•L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )
| A. | BaCl2 NaOH NaHCO3 | B. | NaHCO3 CaCl2 HCl | ||
| C. | AlCl3 MgCl2 NaOH | D. | Ba(OH)2 CaCl2 H2SO4 |
7.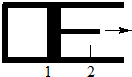 一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )
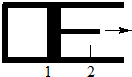 一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )| A. | x+y<z | B. | 平衡向逆反应方向移动 | ||
| C. | B的转化率减小 | D. | C的体积分数降低 |
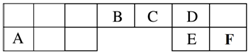 短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素.
短周期元素(前18号元素)A、B、C、D、E、F在元素周期表中的位置如图所示,其中D为地壳中含量最高的元素. .
.