题目内容
1.下列三组物质中,均有一种物质的类别与其它三种不同A.MgO、Na2O、CO2、CuO
B.HCl、H2O、H2SO4、HNO3
C.NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):ACO2;BH2O;CNa2CO3.
(2)这三种物质相互作用可生成一种新物质,该反应非氧化还原反应(填“是”或“非”).
(3)写出这种新物质与足量盐酸反应的离子方程式:HCO3-+H+=H2O+CO2↑
(4)写出这种新物质与过量澄清石灰水反应的离子方程式:HCO3-+OH-+Ca2+=CaCO3↓+H2O.
分析 (1)A中利用金属氧化物、非金属氧化物分析;
B利用是否为酸分析;
C.利用是否为碱分析;
(2)CO2、H2O、Na2CO3发生化合反应生成NaHCO3,没有元素的化合价变化;
(3)碳酸氢钠与盐酸反应生成氯化钠和水、二氧化碳;
(4)碳酸氢钠与过量澄清石灰水反应生成碳酸钙、水、NaOH.
解答 解:(1)A.MgO、Na2O、CO2、CuO 都是氧化物,其中MgO、Na2O、CuO是金属氧化物,CO2是非金属氧化物;
B.HCl、H2SO4、H2SiO3 都是酸,H2O是氧化物;
C.NaOH、KOH、Fe(OH)3都是碱,Na2CO3属于盐,
故答案为:CO2;H2O;Na2CO3;
(2)CO2、H2O、Na2CO3发生化合反应生成NaHCO3,没有元素的化合价变化,该反应为非氧化还原反应,故答案为:非;
(3)三种物质反应的产物为NaHCO3,与足量盐酸反应的离子方程式为HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑;
(4)碳酸氢钠与过量澄清石灰水反应生成碳酸钙、水、NaOH,离子反应为HCO3-+OH-+Ca2+=CaCO3↓+H2O,故答案为:HCO3-+OH-+Ca2+=CaCO3↓+H2O.
点评 本题考查离子反应方程式的书写及氧化还原反应,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意物质类别的判断,题目难度不大.

练习册系列答案
相关题目
11.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 往CuCl2溶液中加入钠 2Na+Cu2+═2Na++Cu | |
| C. | 铁与稀硫酸反应 Fe+2H+═Fe2++H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-═H2O+BaSO4↓ |
12.NaNO2是一种食品添加剂,能致癌.酸性KMnO4溶液与NaNO2反应的离子方程式是:MnO4-+NO2-+□→Mn2++NO3-+H2O (未配平),下列叙述中正确的是( )
| A. | 该反应中NO2-被还原 | |
| B. | 生成1mol NaNO3需消耗0.4mol KMnO4 | |
| C. | 反应过程中溶液的pH减小 | |
| D. | □中的粒子是OH- |
9.对于在密闭容器中进行的可逆反应2SO2(g)+18O2(g)?2SO3(g),下列说法正确的是( )
| A. | 容器内只含有18O2、SO2、SO3三种分子 | |
| B. | 18O只存在18O2分子中 | |
| C. | 容器内含有18O2、S18O2、S18O3等分子 | |
| D. | 反应达到限度时,容器内只含有18O2、S18O2、S18O3分子 |
16.已知下列反应,在其变化时,必须加入氧化剂才能实现的是( )
| A. | CaCO3→CO2 | B. | Cl2→HClO | C. | Na→Na+ | D. | Al3+→Al |
10.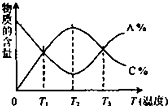 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 升高温度,平衡会向正反应方向移动 | |
| C. | 该反应的逆反应是放热反应 | |
| D. | 该反应在T2温度时达到化学平衡 |
11.下列试剂能用来鉴别乙醇和乙酸的是( )
| A. | 溴水 | B. | 蒸馏水 | C. | 碳酸氢钠溶液 | D. | 氢氧化钠溶液 |