题目内容
下表中的实线表示元素周期表的部分边界.①~⑤分别表示元素周期表中对应位置的元素.
(1)请在上表中用实线补全元素周期表边界.
(2)元素⑤的原子核外p电子数比s电子总数多 个,元素③氢化物的电子式为 .
(3)元素④一般在化合物中显 价,但与 形成化合物时,所显示的价态则恰好相反.
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是 .
A.元素①的单质;
B.元素②的单质;
C.元素①②形成的合金;
D.无法判断.

(1)请在上表中用实线补全元素周期表边界.
(2)元素⑤的原子核外p电子数比s电子总数多
(3)元素④一般在化合物中显
(4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是
A.元素①的单质;
B.元素②的单质;
C.元素①②形成的合金;
D.无法判断.
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表位置,可确定①~⑤元素分别为Na、K、N、O、F.
(1)第一周期中只有H、He两种元素,第二、三周期中3-12列不存在;
(2)F的电子排布为1s22s22p5,据此判断;元素③氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(3)F、O通常只有负化合价,但氧与氟结合时,氧显正价;
(4)合金的熔点通常比各成分金属的低.
(1)第一周期中只有H、He两种元素,第二、三周期中3-12列不存在;
(2)F的电子排布为1s22s22p5,据此判断;元素③氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对;
(3)F、O通常只有负化合价,但氧与氟结合时,氧显正价;
(4)合金的熔点通常比各成分金属的低.
解答:
解:根据元素在周期表中位置,可确定①~⑤元素分别为Na、K、N、O、F.
(1)第一周期中只有H、He两种元素,第二、三周期中3-12列不存在,用实线补全元素周期表边界为: ,
,
故答案为: ;
;
(2)F的电子排布为1s22s22p5,p轨道上的电子比s轨道上的电子多1个,元素③氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为: ,故答案为:1;
,故答案为:1; ;
;
(3)F、O通常只有负化合价,O元素一般在化合物中显-2价,但氧与氟结合时,氧显正价,故答案为:-2;氟;
(4)合金的熔点通常比各成分金属的低,故熔点高低顺序为Na>K>Na-K合金,故答案为:C.
(1)第一周期中只有H、He两种元素,第二、三周期中3-12列不存在,用实线补全元素周期表边界为:
 ,
,故答案为:
 ;
;(2)F的电子排布为1s22s22p5,p轨道上的电子比s轨道上的电子多1个,元素③氢化物为NH3,分子中N原子与H原子之间形成1对共用电子对,电子式为:
 ,故答案为:1;
,故答案为:1; ;
;(3)F、O通常只有负化合价,O元素一般在化合物中显-2价,但氧与氟结合时,氧显正价,故答案为:-2;氟;
(4)合金的熔点通常比各成分金属的低,故熔点高低顺序为Na>K>Na-K合金,故答案为:C.
点评:本题考查元素周期表、核外电子排布、电子式、合金等,题目难度不大,注意对基础知识的理解掌握.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
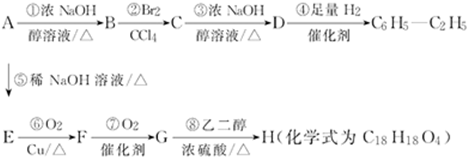
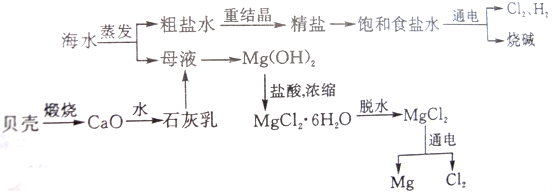
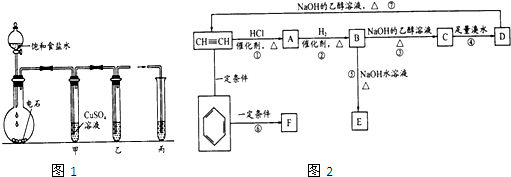
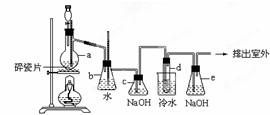 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用下图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白:
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用下图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白: