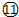题目内容
标准状况下,将4.48L CO2气体通入含0.3mol的NaOH溶液中,充分反应,反应物均无剩余,求产物的组成及对应的物质的量.
考点:化学方程式的有关计算
专题:计算题
分析:可能反应反应:CO2+NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,n(CO2):n(NaOH)=
:0.3mol=2:3,介于2与1之间,故上述两反应都发生,产物为Na2CO3、NaHCO3,根据钠原子、碳原子守恒列方程计算Na2CO3、NaHCO3的物质的量.
| 4.48L |
| 22.4L/mol |
解答:
解:可能反应反应:CO2+NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,n(CO2):n(NaOH)=
:0.3mol=2:3,介于2与1之间,故上述两反应都发生,产物为Na2CO3、NaHCO3,
令Na2CO3、NaHCO3的物质的量分别为xmol、ymol,根据钠原子、碳原子守恒,则:
解得x=y=0.1
答:产物为Na2CO3、NaHCO3,二者物质的量分别为0.1mol、0.1mol.
| 4.48L |
| 22.4L/mol |
令Na2CO3、NaHCO3的物质的量分别为xmol、ymol,根据钠原子、碳原子守恒,则:
|
解得x=y=0.1
答:产物为Na2CO3、NaHCO3,二者物质的量分别为0.1mol、0.1mol.
点评:本题考查化学方程式有关计算,难度不大,根据二氧化碳与氢氧化钠的比例关系判断产物是关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目