题目内容
工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2,冶炼铜的反应为:8CuFeSO2+2IO2
8Cu+4FeO+2Fe2O3+16SO2若CuFeS2中 Fe 的化合价为+2,反应中被还原的元素是 (填元素符号).当生成0.8mol铜时,此反应转移的电子数目是 .
| ||
考点:氧化还原反应的电子转移数目计算
专题:
分析:氧化还原反应中得电子的元素被还原;根据铜和转移电子之间的关系式计算转移电子个数.
解答:
解:反应8CuFeS2+21O2
8Cu+4FeO+2Fe203+16SO2中铜元素、氧元素在得电子化合价降低,被还原;
设转移电子数为x.
8CuFeS2+21O2
8Cu+4FeO+2Fe203+16SO2 转移电子
8mol 100NA
0.8mol x
x=10NA,故答案为:Cu、O;10NA.
| ||
设转移电子数为x.
8CuFeS2+21O2
| ||
8mol 100NA
0.8mol x
x=10NA,故答案为:Cu、O;10NA.
点评:注意明确被还原元素与转移电子之间的关系式在解本题的关键,难点不大.

练习册系列答案
相关题目
能源可划分为一次能源和二次能源,直接来自自然界的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源.下列叙述正确的是( )
| A、水煤气是二次能源 |
| B、水力是二次能源 |
| C、天然气是二次能源 |
| D、电能是一次能源 |
同浓度的Na2CO3和NaHCO3溶液pH不相等,使二者pH相等的方法不可行的是( )
| A、向Na2CO3溶液中加适量水 |
| B、向Na2CO3溶液中加适量NaOH固体 |
| C、向NaHCO3溶液中加适量NaOH固体 |
| D、向Na2CO3溶液中通适量CO2气体 |
胶体区别于其它分散系的本质特征是( )
| A、胶体有丁达尔效应 |
| B、胶体粒子带电荷 |
| C、胶体粒子不能穿过半透膜 |
| D、胶体粒子直径在1-100nm之间 |
已知:H+(aq)+OH- (aq)=H2O(l)△H=-57.3kJ?mol-1,分别向1L0.5moL.L-1的KOH溶液中加入:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应的中和热分别为△H1、△H2、△H3,他们的关系正确的是( )
| A、△H1>△H3>△H2=-57.3 kJ?mol-1 |
| B、△H2<△H1=-57.3 kJ?mol-1<△H3 |
| C、△H1>△H3=-57.3 kJ?mol-1>△H2 |
| D、△H1<△H3=-57.3 kJ?mol-1<△H2 |
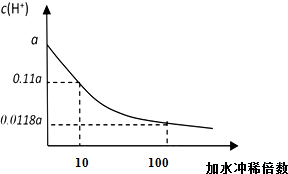 某HA的稀溶液,其浓度为b mol/L,在稀释过程中的c(H+)变化如图所示.
某HA的稀溶液,其浓度为b mol/L,在稀释过程中的c(H+)变化如图所示.