题目内容
氧是地壳中含量最多的元素.
(1)氧元素基态原子核外未成对电子数为 个.
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为 .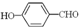 的沸点比
的沸点比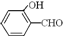 高,原因是 .
高,原因是 .
(3)H+可与H2O形成H3O+,H3O+原子采用 杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为 .
(1)氧元素基态原子核外未成对电子数为
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为
 的沸点比
的沸点比 高,原因是
高,原因是(3)H+可与H2O形成H3O+,H3O+原子采用
考点:化学键和分子间作用力的区别,键能、键长、键角及其应用,原子轨道杂化方式及杂化类型判断,氢键的存在对物质性质的影响
专题:
分析:(1)s能级有一个轨道,最多排2个电子,p能级有3个轨道,每个轨道最多排2个电子,结合洪特规则分析;
(2)化学键的键能大于氢键的键能,氢键的键能大于分子间作用力;氢键对物质的物理性质产生影响,分子间氢键使物质的沸点升高,分子内氢键使物质的沸点降低;
(3)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力.
(2)化学键的键能大于氢键的键能,氢键的键能大于分子间作用力;氢键对物质的物理性质产生影响,分子间氢键使物质的沸点升高,分子内氢键使物质的沸点降低;
(3)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力.
解答:
解:(1)氧元素基态原子核外电子排布式为1s22s22p4,4个电子在三个轨道中排布,故未成对电子数为2个,故答案为:2;
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键.
故答案为:O-H键、氢键、范德华力;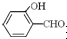 形成分子内氢键,而
形成分子内氢键,而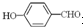 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(3)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键.
故答案为:O-H键、氢键、范德华力;
 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;(3)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大.
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
点评:本题把物质结构和性质与有机化合物的性质融合成一体,考查学生对元素推理、原子轨道杂化类型、分子空间结构、氢键、等电子体原理等知识的掌握和应用能力.本题基础性较强,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol?L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol?L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入NaOH溶液至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
当今世界,环境问题日趋严峻,发展“低碳”经济,实现可持续发展已成为人们的共识.下列施可以提高燃料燃烧效率的是①通入适量的空气②提高燃料的着火点③降低燃料的着火点④将煤气化处理⑤将液体燃料化⑥将固体燃料粉碎( )
| A、①④⑤⑥ | B、①②③④ |
| C、③④⑤⑥ | D、②④⑤⑥ |
某温度下,H2(g)+CO2(g)?H2O(g)+CO(g) 的平衡常数K=2.25.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)mol/L | 0.010 | 0.010 | 0.020 |
| A、平衡时,乙中CO2的转化率大于60% |
| B、平衡时,甲中和丙中H2的转化率均是60% |
| C、平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L |
| D、反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |


