题目内容
某溶液中可能含有Cl-、CH3COO-、HCO3-、NH4+、Na+等离子.
(1)若溶液中还存在较多的H+,则溶液中可能含有上述离子中的 ,其它离子不存在的理由是(用离子方程式表示) ;
(2)若溶液中还存在较多的OH-,则溶液中可能含有上述离子中的 ,其它离子不存在的理由是(用离子方程式表示) .
(1)若溶液中还存在较多的H+,则溶液中可能含有上述离子中的
(2)若溶液中还存在较多的OH-,则溶液中可能含有上述离子中的
考点:离子共存问题
专题:
分析:(1)若溶液中还存在较多的H+,溶液呈酸性,则溶液中不能大量存在弱酸根离子、氢氧根离子、弱酸酸式酸根离子等;
(2)若溶液中还存在较多的OH-,溶液呈碱性,则溶液中不能大量存在氢离子、酸式酸根离子、和氢氧根离子反应生成沉淀或弱电解质的离子等.
(2)若溶液中还存在较多的OH-,溶液呈碱性,则溶液中不能大量存在氢离子、酸式酸根离子、和氢氧根离子反应生成沉淀或弱电解质的离子等.
解答:
解:(1)若溶液中还存在较多的H+,溶液呈酸性,则溶液中不能大量存在弱酸根离子、氢氧根离子、弱酸酸式酸根离子等,CH3COO-是弱酸根离子、HCO3-是弱酸酸式酸根离子,都能和氢离子反应,发生的反应为CH3COO-+H+=CH3COOH,HCO3-+H+=CO2↑+H2O,所以不能存在,
故答案为:CH3COO-、HCO3-;CH3COO-+H+=CH3COOH,HCO3-+H+=CO2↑+H2O;
(2)若溶液中还存在较多的OH-,溶液呈碱性,则溶液中不能大量存在氢离子、酸式酸根离子、和氢氧根离子反应生成沉淀或弱电解质的离子等,能和氢氧根离子反应的微粒有HCO3-、NH4+,发生的反应方程式为HCO3-+OH-=H2O+CO32-、NH4++OH-=NH3.H2O,故答案为:HCO3-、NH4+;HCO3-+OH-=H2O+CO32-、NH4++OH-=NH3.H2O.
故答案为:CH3COO-、HCO3-;CH3COO-+H+=CH3COOH,HCO3-+H+=CO2↑+H2O;
(2)若溶液中还存在较多的OH-,溶液呈碱性,则溶液中不能大量存在氢离子、酸式酸根离子、和氢氧根离子反应生成沉淀或弱电解质的离子等,能和氢氧根离子反应的微粒有HCO3-、NH4+,发生的反应方程式为HCO3-+OH-=H2O+CO32-、NH4++OH-=NH3.H2O,故答案为:HCO3-、NH4+;HCO3-+OH-=H2O+CO32-、NH4++OH-=NH3.H2O.
点评:本题考查离子共存,明确离子共存的条件是解本题关键,为高考热点,注意题给信息中限制性条件,有时还与盐类水解、氧化还原反应等联合考查,题目难度中等.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
有一瓶14%的氢氧化钾溶液,加热蒸发掉100g水后,得到28%的氢氧化钾溶液80mL,所得溶液的浓为( )
| A、5mol/L |
| B、6.25mol/L |
| C、6.5mol/L |
| D、8.2mol/L |
取镁铝合金粉末若干,用足量的盐酸溶解后,再向溶液中加入过量的NaOH溶液,将生成的沉淀过滤、洗涤、灼烧,得到的白色粉末与原合金粉末质量相等,则原合金中镁的质量分数是( )
| A、30% | B、40% |
| C、50% | D、60% |
下列关于同分异构体的叙述中正确的是( )
| A、二氯甲烷有两种同分异构体 |
| B、丙烷的二氯代物有四种同分异构体,则其六氯代物也有四种同分异构体 |
| C、(CH3CH2)2CHCH3一氯取代物有两种同分异构体 |
| D、烷烃失去一个氢原子剩余的原子团叫烷基,苯环上的氢原子被烷基取代后、和苯分子相差若干CH2的物质是苯的同系物,则苯的同系物C8H10有三种同分异构体 |
硅被誉为无机非金属材料的主角.下列制品用到硅单质的是( )
| A、陶瓷餐具 | B、玻璃茶具 |
| C、计算机芯片 | D、光导纤维 |
在酸性的无色溶液中,能大量共存的离子组是( )
| A、NH4+、Na+、CO32-、NO3- |
| B、Ag+、Na+、NO3-、Cl- |
| C、Na+、Cu2+、Cl-、SO42- |
| D、K+、Na+、NO3-、SO42- |
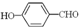 的沸点比
的沸点比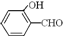 高,原因是
高,原因是