题目内容
2011年我国各地出现连续干旱,给生产生活带来严重影响.为确保人、畜用水和安全,净水剂选择与制备尤为重要.
(1)漂白粉是生活用水常见的消毒剂之一,其工业制法的反应方程式: .
(2)聚合氯化铝晶体([Al2(OH)nC16-n?xH2O]m)是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出.利用高岭土(化学组成为:A12O3、SiO2、Fe2O3,及少量杂质和水分)制备聚合氯化铝的过程如图1.

①用浓盐酸配制1:1(体积比)的稀盐酸,应选用的仪器是 .
a.量筒 b.胶头滴管 c.容量瓶 d.烧杯 e.玻璃棒
②加适量铝粉的目的是除去溶液中的铁元素,检验溶液中铁元素是否除净的方法为 .
③加入碳酸钙调节溶液pH至4.0~4.5的目的是 .
(3)Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图2所示,请根据图示分析:Fe电极的电极反应方程式为 .

(4)用地下水作为锅炉用水时容易产生水垢.水垢造成能源浪费,还会造成安全隐患,因此要定期清除.水垢处理过程如图3:
(已知:Ksp(CaSO4)=7.5×10-5 Ksp(CaCO3)=3.0×10-9)
①用饱和Na2CO3溶液浸泡水垢时,发生的反应为:CaSO4(S)+CO32-(aq)?CaCO3(S)+SO42-(aq),该反应的平衡常数K= .(填数值)
②请从溶解平衡的角度解释用醋酸除水垢的原因 (用离子方程式和必要的文字说明).
(1)漂白粉是生活用水常见的消毒剂之一,其工业制法的反应方程式:
(2)聚合氯化铝晶体([Al2(OH)nC16-n?xH2O]m)是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出.利用高岭土(化学组成为:A12O3、SiO2、Fe2O3,及少量杂质和水分)制备聚合氯化铝的过程如图1.

①用浓盐酸配制1:1(体积比)的稀盐酸,应选用的仪器是
a.量筒 b.胶头滴管 c.容量瓶 d.烧杯 e.玻璃棒
②加适量铝粉的目的是除去溶液中的铁元素,检验溶液中铁元素是否除净的方法为
③加入碳酸钙调节溶液pH至4.0~4.5的目的是
(3)Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图2所示,请根据图示分析:Fe电极的电极反应方程式为

(4)用地下水作为锅炉用水时容易产生水垢.水垢造成能源浪费,还会造成安全隐患,因此要定期清除.水垢处理过程如图3:
(已知:Ksp(CaSO4)=7.5×10-5 Ksp(CaCO3)=3.0×10-9)
①用饱和Na2CO3溶液浸泡水垢时,发生的反应为:CaSO4(S)+CO32-(aq)?CaCO3(S)+SO42-(aq),该反应的平衡常数K=
②请从溶解平衡的角度解释用醋酸除水垢的原因
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)漂白粉的工业制法是用Cl2和石灰乳反应制得的,生成氯化钙、次氯酸钙和水;
(2)分析制备流程,①是粗略配制溶液,可选用量筒、烧杯和玻璃棒;
②该过程中铁元素的存在形式为Fe2+,检验除净的方法:取少量溶液于洁净的试管中,滴加KSCN溶液无明显现象,然后滴加氯水也无明显现象,证明溶液中铁元素已经除净;
③加入碳酸钙主要目的是调节增大溶液的pH,促使其水解而结晶析出;
(3)根据电解池原理,在阳极上失电子发生氧化反应,铁在碱溶液中失电子生成高铁酸盐;
(4)①依据溶度积常数和化学反应的平衡常数表达式计算得到;
②醋酸除水垢是利用醋酸溶液中氢离子结合沉淀溶解平衡状态下的氢氧根离子、碳酸根离子,促进沉淀溶解方向进行,沉淀溶解;
(2)分析制备流程,①是粗略配制溶液,可选用量筒、烧杯和玻璃棒;
②该过程中铁元素的存在形式为Fe2+,检验除净的方法:取少量溶液于洁净的试管中,滴加KSCN溶液无明显现象,然后滴加氯水也无明显现象,证明溶液中铁元素已经除净;
③加入碳酸钙主要目的是调节增大溶液的pH,促使其水解而结晶析出;
(3)根据电解池原理,在阳极上失电子发生氧化反应,铁在碱溶液中失电子生成高铁酸盐;
(4)①依据溶度积常数和化学反应的平衡常数表达式计算得到;
②醋酸除水垢是利用醋酸溶液中氢离子结合沉淀溶解平衡状态下的氢氧根离子、碳酸根离子,促进沉淀溶解方向进行,沉淀溶解;
解答:
解:(1)漂白粉的工业制法是用Cl2和石灰乳反应制得的,其反应方程式为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(2)分析制备流程,①是粗略配制溶液,可选用量筒、烧杯和玻璃棒;
故答案为:a、d、e;
②该过程中铁元素的存在形式为Fe2+,检验除净的方法:取少量溶液于洁净的试管中,滴加KSCN溶液无明显现象,然后滴加氯水也无明显现象,证明溶液中铁元素已经除净;
故答案为:取少量溶液于洁净的试管中,滴加KSCN溶液无明显现象,然后滴加氯水也无明显现象,证明溶液中铁元素已经除净;
③加入碳酸钙主要目的是调节增大溶液的pH,促使其水解而结晶析出;
故答案为:调节增大溶液的pH,促使其水解而结晶析出;
(3)根据电解池原理,在阳极上失电子发生氧化反应,所以该电极反应式为:Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O;
(4)①用饱和Na2CO3溶液浸泡水垢时,发生的反应为:CaSO4(S)+CO32-(aq)?CaCO3(S)+SO42-(aq),该反应的平衡常数K=
=
=
=
=2.5×104;
故答案为:2.5×104;
②醋酸除水垢是利用醋酸溶液中氢离子结合沉淀溶解平衡状态下的氢氧根离子、碳酸根离子,促进沉淀溶解方向进行,沉淀溶解,在溶液中存在Mg(OH)2的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq);醋酸溶液中的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解;同理H+也能碳酸钙溶解平衡中的CO32-反应,使CO32-浓度减小,促进溶解平衡右移;
故答案为:在溶液中存在Mg(OH)2的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq);醋酸溶液中的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解;同理H+也能碳酸钙溶解平衡中的CO32-反应,使CO32-浓度减小,促进溶解平衡右移;
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(2)分析制备流程,①是粗略配制溶液,可选用量筒、烧杯和玻璃棒;
故答案为:a、d、e;
②该过程中铁元素的存在形式为Fe2+,检验除净的方法:取少量溶液于洁净的试管中,滴加KSCN溶液无明显现象,然后滴加氯水也无明显现象,证明溶液中铁元素已经除净;
故答案为:取少量溶液于洁净的试管中,滴加KSCN溶液无明显现象,然后滴加氯水也无明显现象,证明溶液中铁元素已经除净;
③加入碳酸钙主要目的是调节增大溶液的pH,促使其水解而结晶析出;
故答案为:调节增大溶液的pH,促使其水解而结晶析出;
(3)根据电解池原理,在阳极上失电子发生氧化反应,所以该电极反应式为:Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O;
(4)①用饱和Na2CO3溶液浸泡水垢时,发生的反应为:CaSO4(S)+CO32-(aq)?CaCO3(S)+SO42-(aq),该反应的平衡常数K=
| c(SO42-) |
| c(CO32-) |
| c(SO42-)c(Ca2+) |
| c(CO32-)c(Ca2+) |
| Ksp(CaSO4) |
| Ksp(CaCO3) |
| 7.5×10-5 |
| 3.0×10-9 |
故答案为:2.5×104;
②醋酸除水垢是利用醋酸溶液中氢离子结合沉淀溶解平衡状态下的氢氧根离子、碳酸根离子,促进沉淀溶解方向进行,沉淀溶解,在溶液中存在Mg(OH)2的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq);醋酸溶液中的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解;同理H+也能碳酸钙溶解平衡中的CO32-反应,使CO32-浓度减小,促进溶解平衡右移;
故答案为:在溶液中存在Mg(OH)2的溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq);醋酸溶液中的H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解;同理H+也能碳酸钙溶解平衡中的CO32-反应,使CO32-浓度减小,促进溶解平衡右移;
点评:本题考查了物质制备方法和实验探究,沉淀溶解平衡状态的分析计算,影响反应速率的理解应用是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
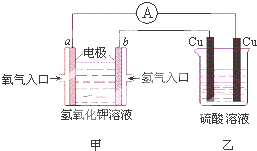 根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )
根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )| A、利用该反应可持续产生硫酸铜直至硫酸耗尽 | ||||
| B、甲中a电极的电极反应为:O2+4H++4e-=2H2O | ||||
C、装置开始工作初期乙中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中甲、乙装置中溶液的pH都逐渐减小 |
有一瓶14%的氢氧化钾溶液,加热蒸发掉100g水后,得到28%的氢氧化钾溶液80mL,所得溶液的浓为( )
| A、5mol/L |
| B、6.25mol/L |
| C、6.5mol/L |
| D、8.2mol/L |
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1 mol-CH3含有9 NA个电子 |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
取镁铝合金粉末若干,用足量的盐酸溶解后,再向溶液中加入过量的NaOH溶液,将生成的沉淀过滤、洗涤、灼烧,得到的白色粉末与原合金粉末质量相等,则原合金中镁的质量分数是( )
| A、30% | B、40% |
| C、50% | D、60% |
下列关于同分异构体的叙述中正确的是( )
| A、二氯甲烷有两种同分异构体 |
| B、丙烷的二氯代物有四种同分异构体,则其六氯代物也有四种同分异构体 |
| C、(CH3CH2)2CHCH3一氯取代物有两种同分异构体 |
| D、烷烃失去一个氢原子剩余的原子团叫烷基,苯环上的氢原子被烷基取代后、和苯分子相差若干CH2的物质是苯的同系物,则苯的同系物C8H10有三种同分异构体 |
下列有关胶体的说法不正确的是( )
| A、胶体均为无色透明的液体 |
| B、利用丁达尔效应可以区分胶体和溶液 |
| C、胶体中分散质粒子的直径在1~100 nm之间 |
| D、向沸水中逐滴加入少量FeCl3饱和溶液,可制得Fe(OH)3胶体 |
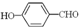 的沸点比
的沸点比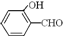 高,原因是
高,原因是