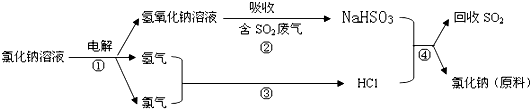
题目内容
将饱和三氯化铁溶液滴入沸水中时,液体变为 色,得到的是 ,用此分散系进行实验:
(1)将其装入U形管中,用石墨作电极,接通直流电源,通电一段时间后发现阴极附近颜色 ,这表明 ,这种现象称为 .
(2)向其中逐滴加入过量稀硫酸,现象是 ,原因是 .
(1)将其装入U形管中,用石墨作电极,接通直流电源,通电一段时间后发现阴极附近颜色
(2)向其中逐滴加入过量稀硫酸,现象是
考点:胶体的重要性质
专题:
分析:将饱和的FeCl3溶液逐滴滴入沸水中,液体变为红褐色,得到的是Fe(OH)3胶体.
(1)发现阴极附近颜色逐渐变深,这表明Fe(OH)3胶粒带正电荷,这种现象为电泳;
(2)向其中逐滴加入过量稀硫酸,现象是先出现红褐色沉淀,后沉淀溶解,原因从胶体的聚沉和化学反应考虑.
(1)发现阴极附近颜色逐渐变深,这表明Fe(OH)3胶粒带正电荷,这种现象为电泳;
(2)向其中逐滴加入过量稀硫酸,现象是先出现红褐色沉淀,后沉淀溶解,原因从胶体的聚沉和化学反应考虑.
解答:
解:将饱和的FeCl3溶液逐滴滴入沸水中,液体变为红褐色,得到的是Fe(OH)3胶体,
故答案为:红褐色;Fe(OH)3胶体;
(1)将其装入U形管中,用石墨作电极,接通直流电源,通电一段时间后发现阴极附近颜色,表明Fe(OH)3胶粒带正电荷,这种现象称为电泳,
故答案为:逐渐变深;正电荷;电泳;
(2)向Fe(OH)3胶体加入电解质使胶体聚沉出现红褐色的Fe(OH)3沉淀,稀硫酸与氢氧化铁发生化学反应而溶解,因此现象为先出现红褐色沉淀后沉淀溶解,
故答案为:先出现红褐色沉淀后沉淀溶解;加入电解质使胶体聚沉出现红褐色的Fe(OH)3沉淀,再继续滴加使Fe(OH)3沉淀溶解.
故答案为:红褐色;Fe(OH)3胶体;
(1)将其装入U形管中,用石墨作电极,接通直流电源,通电一段时间后发现阴极附近颜色,表明Fe(OH)3胶粒带正电荷,这种现象称为电泳,
故答案为:逐渐变深;正电荷;电泳;
(2)向Fe(OH)3胶体加入电解质使胶体聚沉出现红褐色的Fe(OH)3沉淀,稀硫酸与氢氧化铁发生化学反应而溶解,因此现象为先出现红褐色沉淀后沉淀溶解,
故答案为:先出现红褐色沉淀后沉淀溶解;加入电解质使胶体聚沉出现红褐色的Fe(OH)3沉淀,再继续滴加使Fe(OH)3沉淀溶解.
点评:本题考查胶体的性质,难度不大,掌握胶体的制备、明确胶体聚沉的条件和化学反应是解题的关键.

练习册系列答案
相关题目
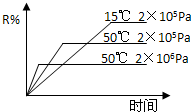 在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)?R(g)+2X,该反应中R的体积分数如图所示,下列情况正确的是( )| A、正反应为吸热反应,X为气体 |
| B、正反应为吸热反应,X为固体或液体 |
| C、正反应为放热反应,X为气体 |
| D、正反应为放热反应,X为固体或液体 |
取镁铝合金粉末若干,用足量的盐酸溶解后,再向溶液中加入过量的NaOH溶液,将生成的沉淀过滤、洗涤、灼烧,得到的白色粉末与原合金粉末质量相等,则原合金中镁的质量分数是( )
| A、30% | B、40% |
| C、50% | D、60% |
硅被誉为无机非金属材料的主角.下列制品用到硅单质的是( )
| A、陶瓷餐具 | B、玻璃茶具 |
| C、计算机芯片 | D、光导纤维 |
在酸性的无色溶液中,能大量共存的离子组是( )
| A、NH4+、Na+、CO32-、NO3- |
| B、Ag+、Na+、NO3-、Cl- |
| C、Na+、Cu2+、Cl-、SO42- |
| D、K+、Na+、NO3-、SO42- |
下列有关阿伏加德罗常数(NA)的说法不正确的是( )
| A、32 g O2所含的原子数目为NA |
| B、1mol Na2SO4溶于水中,所得溶液中Na+个数为2NA |
| C、1 mol H2O含有的H2O分子数目为NA |
| D、0.5 NA个氧气分子的物质的量是0.5 mol |
下列反应中属于氧化还原应,但水既不作氧化剂又不作还原剂的是( )
| A、Cl2+H2O=HCl+HClO |
| B、2F2+2H2O=4HF+O2 |
| C、Na2O+H2O=2NaOH |
| D、2Na+2H2O=2NaOH+H2 |
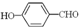 的沸点比
的沸点比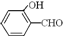 高,原因是
高,原因是