题目内容
1. 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]•xH2O)是一种光敏材料,110℃时失去全部结晶水.某实验小组为测定该晶体中铁的含量,做了如下实验,完成下列填空:步骤一:称取5.0g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加H2SO4酸化,滴加KMnO4溶液,发生反应
2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O(Mn2+视为无色).向反应后的溶液中加入锌粉,
加热至黄色刚好消失,过滤并洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,滴定中MnO4-被还原成Mn2+.消耗KMnO4溶液体积如表所示:
| 滴定次数 | 滴定起始读数(mL) | 滴定终点读数(mL) |
| 第一次 | 1.08 | 见右图 |
| 第二次 | 2.02 | 24.52 |
| 第三次 | 1.00 | 20.98 |
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应.
(3)写出步骤三中发生反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(4)实验测得该晶体中铁元素的质量分数为11.2%.在步骤二中,若滴加的KMnO4溶液的量不够,则测得铁的含量偏高.(选填“偏低”、“偏高”或“不变”)
分析 (1)根据配制一定物质的量浓度的溶液的操作步骤判断:在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液→洗涤并转移→定容→摇匀等步骤;配制过程中的溶液均转移至250mL容量瓶中;
(2)锌粉能与Fe3+反应,加入锌粉的目的是将Fe3+恰好还原成Fe2+;
(3)根据物质的性质和书写离子方程式的有关要求书写离子方程式;
(4)根据离子方程式计算,n(Fe)=5n(MnO4-)=5×$\frac{20.02mL+19.98mL}{2}$×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=$\frac{0.56g}{5g}$×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高.
解答 解:(1)在配制三草酸合铁酸钾溶液时,使用到的玻璃仪器包括:烧杯、玻璃棒,还需要250mL容量瓶、定容需要胶头滴管,
故答案为:250mL容量瓶、胶头滴管;
(2)加入锌粉的目的是将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应,
故答案为:将Fe3+恰好还原成Fe2+,使Fe2+在步骤三中与KMnO4发生氧化还原反应;
(3)在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(4)根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×$\frac{20.02mL+19.98mL}{2}$×0.01 mol•L-1×10-3×10=1.0×10-2mol,m(Fe)=56 g•mol-1×1.0×10-2mol=0.56g.晶体中铁的质量分数=$\frac{0.56g}{5g}$×100%=11.2%,若在步骤二中滴入酸性高锰酸钾溶液不足,则会有部分草酸根离子未被氧化,在步骤三中则会造成消耗酸性高锰酸钾溶液的量偏大,从而计算出的铁的量增多,含量偏高,故答案为:11.2%;偏高.
点评 本题考查物质的含量的测定,为高考常见题型,侧重考查学生的分析能力、实验能力和计算能力,题目主要涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.

| A. | 少量SO2通入足量NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | 将氨通入稀硫酸中:NH3+H+═NH4+ | |
| C. | 在NaOH溶液中滴入NH4Cl溶液并加热:NH4+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O | |
| D. | 向Ba(OH)2溶液中加入稀H2SO4恰好完全反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | 氰的分子式为(CN)2,分子中含有3个σ键和4个π键 | |
| B. | 甲醇(CH3OH)分子内的O-C-H键角小于甲醛(HCHO)分子内的O-C-H键角 | |
| C. | 第二周期基态原子未成对电子数与Ni相同且第一电离能最小的元素是氧 | |
| D. | 二氧化硅晶体中最小的环有3个硅原子、3个氧原子 |
| A. | 该变化说明原子核在化学反应中也能发生变化 | |
| B. | 该变化遵循质量守恒定律 | |
| C. | 1n是一种电中性粒子 | |
| D. | 对于30P:原子序数=质子数=中子数=核外电子数 |
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
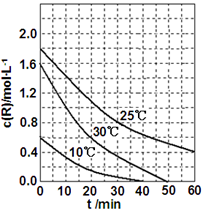 为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )
为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图.下列说法不正确的是( )| A. | 25℃时,在10~30min内,R 的分解平均速率为0.030 mol•L-1•min-1 | |
| B. | 对比30℃和10℃曲线,在50min时,R的分解百分率相等 | |
| C. | 对比30℃和25℃曲线,在0~50min内,能说明R的分解平均速率随温度升高而增大 | |
| D. | 对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大 |
| A. | 混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| B. | c(A-)+c(HA)=2c (Na+)=0.4 mol/L | |
| C. | HA溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$与上述混合溶液中$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$相等 | |
| D. | c(A-)-c(HA)=2 c (H+)-c (OH-) |

 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).