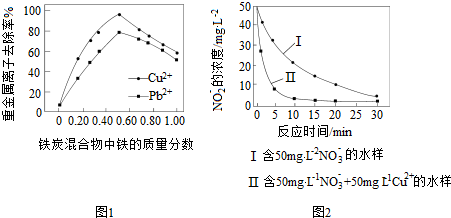
题目内容
1.设NA为阿伏伽德罗常数的值.下列说正确的是( )| A. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1LpH=12的NaOH溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol丙烯酸中含有双键的数目为0.1NA |
分析 A.依据方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2计算;
B.pH=12的氢氧化钡溶液中,氢氧根的浓度为0.01mol/L;
C.氢氧燃料电池负极消耗1 mol H2时,电路中通过电子的数目为2NA,结合电极反应计算;
D.1mol丙烯酸中含2mol双键.
解答 解:A.依据方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,消耗3mol铁生成4mol氢气,则消耗0.2molFe生成$\frac{0.8}{3}$mol氢气,故A错误;
B.pH=12的氢氧化钡溶液中,氢氧根的浓度为0.01mol/L,氢离子浓度=10-12mol/L,故1L溶液中含有的氢氧根的物质的量为0.01mol,水电离出氢氧根离子水个数为10-12NA个,故B错误;
C.氢氧燃料电池负极消耗1 mol H2时,电路中通过电子的数目为2NA,故C正确;
D.丙烯酸中含碳碳双键和碳氧双键,故1mol丙烯酸中含2mol双键,即0.1mol丙烯酸中含有双键的数目为0.2NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,溶液pH值的计算,燃料电池的原理分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
12.下列物质中,不具有漂白作用的是( )
| A. | 活性炭 | B. | 氯气 | C. | 次氯酸溶液 | D. | 二氧化碳 |
16.下列说法中,正确的是( )
| A. | 铝是一种既可以与强酸反应又可以与强碱反应的金属 | |
| B. | 氧化铝按组成划分属于金属氧化物,按性质划分属于碱性氧化物 | |
| C. | 氢氧化铝具有较高的熔点和沸点,常用于制造耐火材料 | |
| D. | 铝是地壳中含量最多的元素,铝土矿是铝元素在地壳中的主要存在形式之一 |
6.下列3个反应:
①S(s)+O2(g)→SO2(g)
②H2(g)+O2(g)→H2O2(l)
③C(s)+H2O(g)→CO(g)+H2(g)
按△S增加的顺序为( )
①S(s)+O2(g)→SO2(g)
②H2(g)+O2(g)→H2O2(l)
③C(s)+H2O(g)→CO(g)+H2(g)
按△S增加的顺序为( )
| A. | ②①③ | B. | ③②① | C. | ②③① | D. | ①③② |
13.关于铭${\;}_{18}^{40}Ar$的说法正确的是( )
| A. | 质子数为18 | B. | 中子数为40 | C. | 质量数为58 | D. | 核外电子数为22 |
11.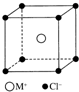 MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
 MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )
MCl晶体具有立方体结构,其晶胞结构如图所示,在该晶体中,每个M+周围与它最接近的且距离相等的M+的个数共有( )| A. | 6个 | B. | 8个 | C. | 12个 | D. | 16个 |