题目内容
13.关于铭${\;}_{18}^{40}Ar$的说法正确的是( )| A. | 质子数为18 | B. | 中子数为40 | C. | 质量数为58 | D. | 核外电子数为22 |
分析 元素符号的左下角表示质子数,左上角表示质量数,质量数=质子数+中子数,电子数=质子数,据此分析.
解答 解:${\;}_{18}^{40}Ar$的元素符号的左下角数字表示质子数,左上角数字表示质量数,中子数=质量数-质子数,原子中核外电子数=核内质子数.
A.质子数为18,故A正确;
B.中子数=质量数-质子数=40-18=22,故B错误;
C.该元素的质量数为40,故C错误;
D.原子中核外电子数=核内质子数=18,故D错误;
故选A.
点评 本题考查了质子数、中子数、质量数之间的关系,难度不大,注意原子或离子中电子数的计算方法,原子中核外电子数=核内质子数,阳离子中电子数=质子数-电荷数,阴离子中电子数=质子数+电荷数.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
9.下列有关物质的量浓度溶液配制的说法中正确的是( )
| A. | 将58.5gNaCl溶于1L水中所得溶液的物质的量浓度为1mol•L-1 | |
| B. | 将5.85molNaCl投入100mL容量瓶中加水至刻度线,充分振荡后浓度为1mol•L-1 | |
| C. | 引流时,玻璃棒可以靠在容量瓶的瓶口上 | |
| D. | 需要480mL0.1mol•L-1的NaCl溶液,配制时应选用500mL容量瓶 |
1.设NA为阿伏伽德罗常数的值.下列说正确的是( )
| A. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1LpH=12的NaOH溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol丙烯酸中含有双键的数目为0.1NA |
8.下列叙述正确的是( )
①两种原子构成的共价化合物分子中的化学键都是极性键;
②两种不同非金属元素原子间形成的化学键都是极性键;
③含有非极性键的化合物一定是共价化合物;
④只由非金属元素形成的化合物一定是共价化合物;
⑤难失去电子的原子,易形成阴离子;
⑥单质分子中不存在化学键,化合物的分子中才存在化学键;
⑦离子化合物中一定含有离子键.
①两种原子构成的共价化合物分子中的化学键都是极性键;
②两种不同非金属元素原子间形成的化学键都是极性键;
③含有非极性键的化合物一定是共价化合物;
④只由非金属元素形成的化合物一定是共价化合物;
⑤难失去电子的原子,易形成阴离子;
⑥单质分子中不存在化学键,化合物的分子中才存在化学键;
⑦离子化合物中一定含有离子键.
| A. | 只有②⑦ | B. | 只有①⑦ | C. | 只有⑦ | D. | 只有①⑤⑦ |
3.今有0.3mol/L K2SO4溶液200mL,0.2mol/L MgSO4溶液300mL和0.1mol/L Al2(SO4)3溶液200mL,这三种溶液中硫酸根离子浓度之比是( )
| A. | 1:1:1 | B. | 3:2:1 | C. | 3:2:3 | D. | 1:1:3 |
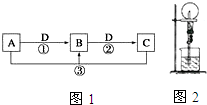 已知A、B、C、D 是中学化学的常见物质.且A、B、C 均含有同一种元索.在一定条件下它们之间的相气转化关系如图1所示(部分反应中的H2O已略去).
已知A、B、C、D 是中学化学的常见物质.且A、B、C 均含有同一种元索.在一定条件下它们之间的相气转化关系如图1所示(部分反应中的H2O已略去).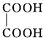
 +NaBr+H2O;
+NaBr+H2O;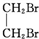 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$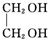 +2NaBr;
+2NaBr; .
.