题目内容
9.对于反应A(g)+3B(g)?2C(g),保持其他条件不变,只改变其中一个条件,将生成C物质的反应速率变化填在下面横线上.(填 增大、减小、或不变)(1)降低温度,反应速率减小
(2)升高温度,反应速率增大
(3)增大B的浓度,反应速率增大
(4)增大压强,反应速率增大
(5)使用催化剂,反应速率增大.
分析 一般来说,升高温度、加入催化剂、增大浓度可增大反应速率,反之降低反应速率,以此解答该题.
解答 解:(1)降低温度,活化分子百分数减小,反应速率减小,故答案为:减小;
(2)升高温度,活化分子的百分数增大,反应速率增大,故答案为:增大;
(3)增大B的浓度,平衡正向移动,生成物活化分子浓度增大,反应速率增大,故答案为:增大;
(4)增大压强,可增大反应物、生成物的浓度,活化分子浓度增大,反应速率增大,故答案为:增大;
(5)使用催化剂,活化分子的百分数增大,反应速率增大,故答案为:增大.
点评 本题考查外界条件对反应速率的影响,为高频考点,侧重于学生的分析能力以及双基的考查,题目难度不大,注意外界条件对活化分子的影响,注重基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1molNaOH的溶液,完全反应,生成NH3 1792ml(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1.87:1 | D. | 3.65:1 |
14.下列物质中,长久露置于空气中会发生颜色变化的是( )
①绿矾 ②氢氧化亚铁 ③氯水 ④苯酚 ⑤亚硫酸钠 ⑥过氧化钠.
①绿矾 ②氢氧化亚铁 ③氯水 ④苯酚 ⑤亚硫酸钠 ⑥过氧化钠.
| A. | 全部 | B. | ①②③④⑥ | C. | 只有①②③ | D. | 只有②③④ |
1.设NA为阿伏伽德罗常数的值.下列说正确的是( )
| A. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| B. | 室温下,1LpH=12的NaOH溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 氢氧燃料电池负极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol丙烯酸中含有双键的数目为0.1NA |
19.涂改液是一种使用率较高的文具,很多同学都喜欢使用涂改液.经实验证实涂改液中含有许多挥发性有害物质,吸入后易引起慢性中毒而头晕、头痛,严重者抽搐、呼吸困难,二氯甲烷就是其中的一种.下列有关说法中不正确的是( )
| A. | 涂改液危害人体健康、污染环境,中小学生最好不要使用或慎用涂改液 | |
| B. | 二氯甲烷沸点较低 | |
| C. | 二氯甲烷易溶于水,涂改液沾到手上时,用水很容易洗去 | |
| D. | 二氯甲烷为四面体的结构,不存在同分异构体 |
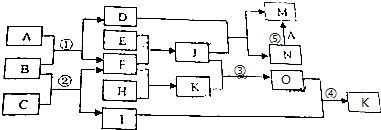
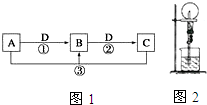 已知A、B、C、D 是中学化学的常见物质.且A、B、C 均含有同一种元索.在一定条件下它们之间的相气转化关系如图1所示(部分反应中的H2O已略去).
已知A、B、C、D 是中学化学的常见物质.且A、B、C 均含有同一种元索.在一定条件下它们之间的相气转化关系如图1所示(部分反应中的H2O已略去).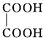
 +NaBr+H2O;
+NaBr+H2O;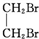 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$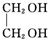 +2NaBr;
+2NaBr;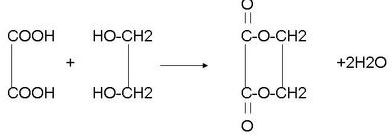 .
.