题目内容
13.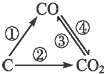 随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).
随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).
分析 依据碳及其化合物性质分析转化关系,①是置换反应可以是碳和水蒸气反应生成一氧化碳和氢气,或与金属氧化物反应,其中碳和水蒸气反应,碳和二氧化碳反应为吸热反应.
解答 解:①是置换反应可以是碳好水蒸气反应生成一氧化碳和氢气,或与金属氧化物反应,其中碳和水蒸气反应,碳和二氧化碳反应为吸热反应即①③为吸热反应;
故答案为:①③.
点评 本题主要考查的是吸热反应的概念,难度不大,属于常考题.

练习册系列答案
相关题目
3.下列关于晶体的叙述中,不正确的是…( )
| A. | 金刚石网状结构中,由共价键形成的碳原子环其中最小环有6个碳原子 | |
| B. | 在氯化钠的晶体中,每个Na+或Cl-的周围都紧邻6个Cl-或Na+ | |
| C. | 在氯化铯晶体中,每个Cs+周围都紧邻8个Cl-,每个Cl-周围也紧邻8个Cs+ | |
| D. | 在干冰的晶体中,每个CO2分子周围都紧邻4个CO2分子 |
18.下列关于卤代烃的说法中正确的是( )
| A. | 所有卤代烃都是难溶于水、密度比水小的液体 | |
| B. | 所有卤代烃在常温下都是液体,且都是非电解质 | |
| C. | 所有卤代烃都含有卤原子 | |
| D. | 所有卤代烃都是通过取代反应制得的 |
2.下列说法不正确的是( )
| A. | 化学反应中的能量变化都表现为热量的变化 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 反应物的总能量低于生成物的总能量时,发生吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
 制取
制取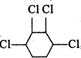 ,即
,即
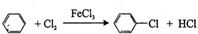 ;⑤
;⑤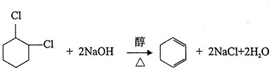 ;⑥
;⑥ .
. .
.
 .
.
 据图回答下列问题:
据图回答下列问题: