题目内容
3. 据图回答下列问题:
据图回答下列问题:(1)若烧杯中溶液为稀硫酸,则观察到的现象是镁逐渐溶解,铝上有气泡冒出,电流表指针偏转(填“偏转”或“不偏转”),两极反应式为:正极2H++2e-═H2↑负极Mg-2e-═Mg2+
(2)若烧杯中溶液为氢氧化钠溶液,则负极为Al(填Mg或Al),总反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示A、B两个电极均由多孔的碳块组成.该电池的负极反应式为:H2+2OH--2e-═2H2O.如果将上述装置中的KOH溶液换成H2SO4溶液,也可以组成一个原电池装置,则该电池的正极反应式为O2+4H++4e-═2H2O.
分析 根据自发的氧化还原反应能设计成原电池,失电子的一极是负极,发生氧化反应,得到电子的是正极,发生还原反应;
在燃料电池中,通入正极的一极氧气,通入负极的一极氧气是燃料,负极的电极反应=总反应-正极的电极反应和,关注电解液是否参与反应;
解答 解:(1)镁、铝和稀硫酸构成了原电池,自发进行的反应是镁和硫酸反应,金属镁做负极,
电极反应:Mg-2e-=Mg2+,金属铝为正极,溶液中的2H+得到电子发生还原反应,电极反应为:2H++2e-=H2↑,
所以可看到镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转,
故答案为:镁逐渐溶解,铝极上有气泡冒出;偏转;2H++2e-=H2↑;Mg-2e-=Mg2+;
(2)镁、铝和氢氧化钠溶液构成了原电池,自发的氧化还原反应是金属铝和氢氧化钠之间的反应,总反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝失电子,为负极,金属镁作正极,
故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)氢气、氧气和氢氧化钾溶液构成了原电池,自发的氧化还原反应是氢气和氧气之间的反应,总反应方程式为:2H2+O2=2H2O,负极上通的是氢气,电解液为碱,故电极反应:H2+2OH--2e-═2H2O;若电解液为酸,正极反应为,O2+4H++4e-=2H2O,故答案为:H2+2OH--2e-═2H2O;O2+4H++4e-=2H2O.
点评 本题考查原电池工作原理知识,可以根据所学知识进行回答,难度不大.需要注意的握以镁、铝为电极材料,电解质溶液的酸碱性不同,电极反应不同.

练习册系列答案
相关题目
14.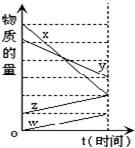 如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
 如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )
如图表示在某温度下经时间t反应后,物质x、y、z、w的物质的量的变化情况.则所发生反应的化学方程式是( )| A. | 4x+2y=z+w | B. | 6x+5y=4z+w | C. | 3w+z=4x+2y | D. | 2x+y=2z+2w |
8.下列过程中,把化学能转化为热能的是( )
| A. | 风力发电 | B. | 干电池产生电流 | C. | 木炭燃烧 | D. | 用电取暖器取暖 |
15.下列化合物的核磁共振氢谱中出现三组峰的是( )
| A. | 2,2,3,3-四甲基丁烷 | B. | 3-甲基-1-丁炔 | ||
| C. | 2,3-二甲基-2-戊烯 | D. | 3,3-二乙基戊烷 |
13.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
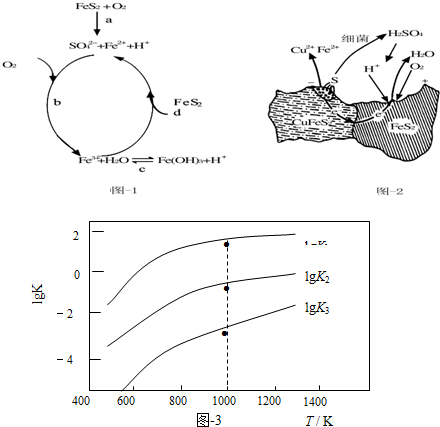
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图-2
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图-3.
①上述反应中,△H1>0(选填:“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.

(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题图-1所示:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题图-2
①冶炼过程中,正极周围溶液的pH增大(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为CuFeS2-4e-=Cu2++Fe2++2S.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题图-3.
| 相关反应 | 反应热 | 平衡常数K |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为lgK2=lgK1+lgK3.
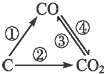 随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号).
随着世界工业经济发展、人口剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.图为C及其氧化物的变化关系图,若变化①是置换反应,图中变化过程哪些是吸热反应①③(填序号). (取代反应)
(取代反应)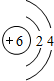 ,C、D、E中原子半径最大的为Na.
,C、D、E中原子半径最大的为Na.