题目内容
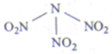 科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )
科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )| A、分子中四个氮原子共平面 |
| B、7.6 g N(NO2)3和N2O3混合物中共含氮原子数为0.2NA |
| C、标准状况下,2.24L N(NO2)3含有的分子数为0.1NA |
| D、15.2g该物质含有0.6NA个非极性键 |
考点:含氮物质的综合应用
专题:氮族元素
分析:A.N-N-N键角都是108.1°具有氨气的结构特点;
B.N(NO2)3的最简式为N2O3,计算可计算N的物质的量;
C.N(NO2)3为液体;
D.根据1个N(NO2)3分子含有3个非极性键判断.
B.N(NO2)3的最简式为N2O3,计算可计算N的物质的量;
C.N(NO2)3为液体;
D.根据1个N(NO2)3分子含有3个非极性键判断.
解答:
解:A.根据题干信息知该分子中N-N-N键角都是108.1°,推知分子中4个氮原子在空间呈四面体型,所以分子中四个氧原子不可能共平面,故A错误;
B.N(NO2)3的最简式为N2O3,7.6 g N(NO2)3和N2O3混合物中n(N2O3)=
=0.1mol,共含氮原子数为0.2NA,故B正确;
C.N(NO2)3为液体,不能计算标准状况下一定体积的物质的量,故C错误;
D.N(NO2)3的相对分子质量为152,15.2 g N(NO2)3为0.1mol,含有的非极性键为0.3NA,故D错误.
故选B.
B.N(NO2)3的最简式为N2O3,7.6 g N(NO2)3和N2O3混合物中n(N2O3)=
| 7.6g |
| 76g/mol |
C.N(NO2)3为液体,不能计算标准状况下一定体积的物质的量,故C错误;
D.N(NO2)3的相对分子质量为152,15.2 g N(NO2)3为0.1mol,含有的非极性键为0.3NA,故D错误.
故选B.
点评:本题为2011年的安徽理综高考题,题干信息比较新颖,同时考查大家熟悉的化学键、分子结构、氧化还原反应和物质的量的相关计算,难度不大.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
向明矾溶液中滴加Ba(OH)2溶液,当SO42-沉淀完全时,铝元素的存在形式是( )
| A、部分为 Al(OH)3沉淀,部分以Al3+形式存在 |
| B、全部以[Al(OH)4]-(AlO2-)的形式存在 |
| C、全部为Al(OH)3沉淀 |
| D、部分为Al(OH)3,部分为[Al(OH)4]- (AlO2-) |
已知碳酸、亚硫酸、次氯酸的平衡常数如表,下列说法正确的是( )
| H2CO3 | H2SO3 | HClO |
| K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A、相同条件下,同浓度的NaClO溶液和Na2CO3溶液的碱性,前者更强 |
| B、Na2CO3溶液中通少量SO2:2CO32-+SO2+H2O═2HCO3-+SO32- |
| C、NaHCO3溶液中通少量SO2:2HCO3-+SO2═CO2+SO32-+H2O |
| D、向氯水中分别加入等浓度的NaHCO3和NaHSO3溶液,均可提高氯水中HClO的浓度 |
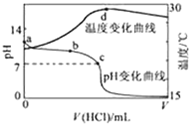 室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol?L-1盐酸滴入20.00mL 1.000mol?L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A、a点由水电离出的c(H+)=1.0×10-14mol/L |
| B、a、b之间可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
| C、c点:c(Cl-)═c(NH4+) |
| D、d点后,溶液温度略下降的主要原因是NH3?H2O电离吸热 |
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成.已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.下列结论不正确的是( )
| A、甲溶液含有Ba2+ |
| B、乙溶液含有SO42- |
| C、丙溶液含有NH4+ |
| D、丁溶液含有HCO3- |
原子总数相同,各原子的外层电子数之和也相同的粒子,互称等电子体.等电子体的结构相似、物理性质相近.下列各组粒子不能互称为等电子体的是( )
| A、14CO和14N2 |
| B、O3和SO2 |
| C、CO2和N2O |
| D、N2H4和C2H4 |