题目内容
9.某草酸晶体的化学式可表示为H2C2O4•xH2O,为测定x的值,进行下列实验:①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL.
(1)若滴定终点时仰视读数,则所测x的值将偏小(填“偏大”或“偏小”).
(2)x=2.
分析 (1)读取读数时仰视,导致KMnO4溶液体积偏大,计算测定的草酸的质量偏大;
(2)依据滴定发生的氧化还原反应离子方程式的定量关系计算得到.
解答 解:(1)读取读数仰视,导致KMnO4溶液体积偏大,计算测定的草酸的质量偏大,故x的值偏小,故答案为:偏小;
(2)由题给化学方程式及数据可知,5H2C2O4+2MnO4-+6 H+═10CO2↑+2 Mn2++8 H2O,7.56g纯草酸晶体中含H2C2O4的物质的量为:0.600 mol/L×10.00 mL×10-3 L/mL×$\frac{5}{2}$×$\frac{100ml}{25ml}$=0.0600 mol,
则7.56g H2C2O4•xH2O中含H2O的物质的量为$\frac{7.56g-0.0600mol×90g/mol}{18g/mol}$=0.12 mol,0.0600mol晶体含水0.160mol,1mol晶体中含的结晶水2mol,则x=2.
故答案为:2.
点评 本题考查中和滴定实验,难度适中,注意掌握草酸含量的计算方法及中和滴定中的误差分析即可解答.

练习册系列答案
相关题目
13.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2LCH3Cl含极性共价键数目为2NA | |
| B. | 0.1L 1.0mol/L Na2S溶液中S2-和HS-总数为0.1NA | |
| C. | 22.4g 铁粉与稀硝酸完全反应时转移的电子数一定为1.2NA | |
| D. | 常温常压下,16g14CH4中所含电子数目为8NA |
14.下列成语或俗语涉及化学变化的是( )
| A. | 滴水成冰 | B. | 聚沙成塔 | C. | 火上浇油 | D. | 铁杵磨成针 |
1.将纯锌片和纯铜片按如图所方式插入同浓度的稀硫酸中,一段时间后,以下叙述正确的是( )

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中化学能转化成了电能 | ||
| C. | 甲中铜片是负极 | D. | 乙中铜片是正极 |
18.下列各组离子一定能在常温指定环境中大量共存的是( )
| A. | 无色溶液中:Al3+、NH4+、Cl-、HCO3- | |
| B. | 甲基橙显红色的溶液中:Fe2+、Na+、SO42-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol•L-1的溶液:K+、HCO3-、I-、ClO- | |
| D. | pH值为1的溶液:Fe2+、Cl-、Na+、SCN- |
19.Ⅰ几种短周期元素的原子半径及主要化合价如表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
(1)R的元素符号为Al; M在元素周期表中的位置为第二周期第VIA族.
(2)X与Y按原子个数比1:1构成的物质的电子式为 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.
(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH?-2e?=Cu(OH)2.
Ⅱ如图转化关系A$\stackrel{+X}{→}$B$\stackrel{+X}{→}$C
①若B为白色胶状不溶物,则A与C反应的离子方程式为Al3++3AlO2?+6H2O=4Al(OH)3↓.
②若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为Fe+2Fe3+=3Fe2+.
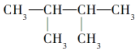 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;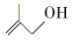 的分子式为C4H8O;
的分子式为C4H8O;