题目内容
2.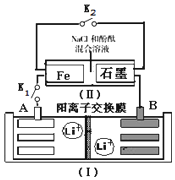 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )| A. | 闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| B. | 闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下) | |
| C. | 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5O12-3e-═Li4Ti5O12+3 Li+ | |
| D. | 若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-═H2↑ |
分析 当闭合K1,断开K2时,Fe电极附近溶液先变红,说明Fe极生成OH-,应为电解池的阴极,发生反应为:2H2O+2e-=H2+2OH-,石墨为电解池的阳极,发生:2Cl--2e-═Cl2↑,则A为原电池的负极,电极反应式为3Li-3e-═3Li+,B为原电池的正极,电极反应式为Li4Ti5O12+3 Li++3e-═Li7Ti5O12,以此解答该题.
解答 解:A.闭合K1,断开K2时,若将Fe电极和石墨电极互换,则Fe作阳极本身失电子,氯离子不能放电生成氯气,故A错误;
B.闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,则理论上转移0.1 mol 电子,又Fe极生成OH-,应为电解池的阴极,发生反应为:2H2O+2e-=H2+2OH-,所以Fe电极上产生的氢气气体体积为$\frac{0.1}{2}$×22.4=1.12 L(标准状况下),故B正确;
C.取下锂离子电池充电,电极A应与电源负极相连,为阴极,发生还原反应,电极上发生的电极反应式为:3Li++3e-═3Li,故C错误;
D.若开始时,断开K1,闭合K2,形成吸氧腐蚀原电池,一段时间后,石墨电极附近显红色,则该电极反应为:O2+2H2O+4e-=4OH-,故D错误;
故选B.
点评 本题考查了原电池及电解池工作原理,难度较大,能准确判断各电极的名称及电极反应是解本题的关键,注意电极反应式的书写,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列有关物质结构的说法正确的是( )
| A. | 共价化合物中各原子最外层都一定满足8电子结构 | |
| B. | BaO2晶体中阳离子与阴离子数目之比为1:2 | |
| C. | H2O是一种非常稳定的化合物,这是由氢键所致 | |
| D. | 在反应2Na2O2+2H2O═4NaOH+O2↑中,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成 |
10.将金属钠分别投入下列物质的水溶液中,生成白色沉淀的是( )
| A. | HCl | B. | BaCl2 | C. | CuCl2 | D. | MgCl2 |
17.下列叙述正确的是( )


| A. | 将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 | |
| B. | 将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色 | |
| C. | 向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 | |
| D. | 向图中烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,一段时间后可看到Fe电极附近有蓝色沉淀生成 |
7.下列说法正确的是( )
| A. | 合成纤维和光导纤维都是新型无机非金属材料 | |
| B. | 明矾净水原理是吸附,不涉及化学变化 | |
| C. | SO2与FeSO4溶液使酸性高锰酸钾的紫色褪去原理相同 | |
| D. | 坩埚主要用于给固体加热,可用坩埚将烧碱加热融化 |
 .
.